

Actualizado el miércoles, 15 febrero 2006 20:38 +0100
2 REGULACIÓN DE LA TRANSCRIPCIÓN
2.1 REGULACIÓN DEL INICIO DE LA TRANSCRIPCIÓN
2.1.1 REGULACIÓN POR SUBUNIDADES s ALTERNATIVAS
2.1.2 REGULACIÓN DEL INICIO DE TRANSCRIPCIÓN POR PROTEÍNAS REGULADORAS
2.1.2.1 EJEMPLO DE CONTROL NEGATIVO E INDUCIBLE: REGULACIÓN DEL OPERÓN lac DE E. coli
2.1.2.2 EJEMPLO DE CONTROL NEGATIVO Y REPRIMIBLE: EL CASO DEL OPERÓN trp DE E. coli
3 SISTEMAS DE REGULACIÓN DE DOS COMPONENTES: SENSORES Y REGULADORES DE RESPUESTA
4 MECANISMOS REGULADORES GLOBALES
4.1 RESPUESTA “SOS” ANTE GRANDES DAÑOS EN EL ADN
ENLACES
![]()
Con este tema comenzamos el estudio de la genética bacteriana, que va a estar centrado alrededor de las variaciones bacterianas. Entendemos por tales los cambios moleculares y eventualmente fenotípicos que se producen en las bacterias por causas genéticas. Dentro de ellos podemos distinguir dos categorías principales:
|
Variaciones bacterianas por adaptación al medio: son cambios moleculares y fenotípicos que ocurren sin modificación del material hereditario (sin variación del genotipo), siendo debidos a diversos mecanismos de regulación de la expresión de los genes. (Las trataremos en el presente tema) | |||||||||||
|
Variaciones bacterianas asociadas a cambios genotípicos. Dentro de esta categoría podemos incluir:
|
Comenzamos, pues, con el estudio de la regulación génica en procariotas. Desde el punto de vista de la expresión genética, los operones bacterianos se pueden dividir en dos grandes tipos:
|
operones de expresión constitutiva (es decir, aquellos que se transcriben permanentemente, independientemente de las condiciones ambientales). Por ejemplo, operones para las ADN- y ARN-polimerasas; operones para las proteínas de las cadenas transportadoras de electrones; operones para las proteínas ribosómicas, etc. | |
|
operones cuya expresión está regulada en función de las condiciones ambientales. Dentro de esta categoría, se distinguen a su vez: operones de expresión inducible y operones de expresión reprimible. |
En principio, por su modo la regulación puede ser de dos tipos :
|
Inducción: síntesis de ciertos enzimas (o aumento de su síntesis) debida a la presencia en el medio de sustratos metabolizables adecuados, o en términos más generales, por la existencia de determinados estímulos ambientales (no necesariamente de tipo nutricional). Ejemplo típico: la producción de b-galactosidasa es inducible en determinadas bacterias cuando en el medio aparece un azúcar de tipo b-galactósido (como la lactosa) | |
|
Represión: desconexión rápida de la ruta biosintética de un determinado compuesto, cuando éste aparece aportado en el medio de la bacteria. Ejemplo típico: si E. coli crece en ausencia de triptófano (Trp), la ruta para su biosíntesis está funcionando hasta que ese aa. aparezca en el medio. La represión no siempre tiene que ver con estímulos nutricionales: se pueden desconectar genes para evitar que su expresión interfiera con otros procesos que ya están en curso en la célula. |
En resumen, y en relación con el modo de expresión genética que subyace a sustancias relacionadas con el metabolismo, la norma general es que:
|
la inducción permite el ajuste rápido para el uso de sustratos metabolizables; | |
|
la represión permite el ajuste para la síntesis de una sustancia que interviene como intermediario metabólico. |
TIPOS DE MECANISMOS DE REGULACIÓN GENÉTICA
Casi cada uno de los niveles de los que depende la expresión de información genética puede estar sometido en principio a algún tipo de regulación, aunque el más frecuente es sobre la transcripción.
1) Nivel transcripcional y sobre el ARNm
a) A nivel del inicio de la transcripción
i) sustitución del factor s de la ARN-polimerasa
ii) por interacción de proteínas regulatorias sobre secuencias de ADN cercanas al promotor:
(1) fenómenos de inducción génica
(2) fenómenos de represión génica
A su vez, estos fenómenos pueden realizarse por:
|
mecanismos de control positivo | |
|
mecanismos de control negativo |
b) Terminación prematura de la transcripción: fenómenos de atenuación de la transcripción.
c) Procesamiento de ARN (casos muy raros en procariotas)
2) Nivel traduccional. Ejemplos:
a) regulación de la síntesis de las proteínas ribosómicas.
b) regulación por ARN antisentido, que interfiere con la traducción del ARNm
3) Nivel postraduccional. Aquí ya no estamos ante mecanismos puramente de regulación genética. Algunos ejemplos: degradación de proteínas y modificación covalente de proteínas (p. ej., fosforilación). Regulación alostérica por retroalimentación (feed-back) de la actividad de las proteínas enzimáticas.
4) Sistemas globales de regulación
Cuando varios operones están regulados coordinadamente por un mismo tipo de estímulos, constituyen una red de regulación que se suele denominar con el nombre de regulón (p. ej., el regulón de los operones spo de la esporulación en las especies del género Bacillus).
Casi todos los productos de genes bacterianos están regulados en al menos uno de estos niveles, y a menudo lo están en varios niveles al mismo tiempo.
Como veremos enseguida, muchos de estos mecanismos se disparan en el interior celular debido a pequeñas moléculas que informan a la bacteria de un determinado cambio ambiental.
Se trata de una estrategia muy directa y sencilla, en la que la subunidad s estándar de la célula vegetativa normal se ve desplazada y sustituida por otro(s) tipo(s) de s diferentes (codificadas por genes distintos). La holoenzima de la ARN polimerasa con la nueva s reconoce ahora e inicia la transcripción a partir de un tipo distinto de promotor. Esto hace que se transcriban operones que hasta entonces permanecían “silenciosos” (sin expresión).
Veamos algunos ejemplos:
|
Uno de los casos mejor estudiados se da en las especies del gén. Bacillus, durante el proceso de la esporulación: Durante el crecimiento vegetativo, B. subtilis posee una holoenzima típica a2bb'+ s43 (= sA), que reconoce los promotores “estándar” de los operones vegetativos. Al iniciarse la esporulación, se sintetiza en la preespora una nueva s, llamada sF, que desplaza parcialmente a la sA (vegetativa). Ahora, la holoenzima reconoce los promotores de algunos operones spo (que estaban inactivos durante el crecimiento vegetativo), que codifican funciones requeridas durante las primeras fases de la esporulación. Uno de los genes que ahora se expresa corresponden a otra subunidades s (sG) distinta de las dos citadas, y que permite a la polimerasa transcribir en la preespora una nueva oleada de operones spo, más tardíos. En una fase más avanzada de la esporulación, se expresan en la célula madre otros genes spo debido a la activación de una nueva s (sK). Cada nueva holoenzima reconoce un tipo distinto y característico de promotor (con secuencias de nucleótidos peculiares), que no puede ser reconocido por las otras versiones de la ARN polimerasa dotadas de subunidades s diferentes. | |||||||||
|
En Escherichia coli existe una subunidad s “estándar”, que es la s70, implicada en el inicio de la transcripción de la mayoría de los genes relacionados con el crecimiento en condiciones normales. Sin embargo, para ciertas condiciones y procesos especiales, la expresión de ciertos genes requiere el uso de subunidades s especiales:
|
Como ya apuntamos, podemos encontrar dos tipos de fenómenos:
|
inducción: el desencadenante del ajuste se denomina inductor; | |
|
represión: el desencadenante del ajuste se denomina correpresor. |
En general, los desencadenantes de la respuesta se llaman efectores, y suelen ser moléculas de pequeño tamaño. Si estamos tratando con respuestas adaptativas metabólicas, podemos hacer la siguiente generalización:
|
El inductor suele ser el sustrato de una ruta catabólica, o una molécula muy semejante al sustrato natural. | |
|
El correpresor suele ser el producto de una ruta biosintética, o una molécula parecida. |
El funcionamiento de estas moléculas en su papel de efectores no depende de su interacción metabólica en la ruta correspondiente. Lo que hacen los efectores es interactuar con proteínas reguladoras específicas para cada sistema (de cada operón o de cada grupo de operones). Y, a su vez, las proteínas reguladoras interactúan con una zona del operón cercana al promotor. Es frecuente que muchas proteínas reguladoras bacterianas compartan un dominio tridimensional característico denominado hélice-giro-hélice, que las capacita para reconocer determinadas secuencias del ADN al comienzo del operón, cerca del promotor (o incluso superspuesto al promotor).
Tanto la inducción como la represión génicas de funciones pueden deberse a su vez a:
|
controles positivos; | |
|
controles negativos. |
Así pues, en la regulación del sistema tenemos varios tipos de elementos:
a) efectores: pequeñas moléculas que informan del ambiente exterior;
b) un elemento regulatorio que actúa en trans (a distancia): un gen regulador que codifica una proteína cuya única función consiste en controlar la expresión (a nivel de inicio de transcripción) de un operón de genes estructurales.
c) genes estructurales (normalmente agrupados en operones, donde los genes se co-transcriben en forma de ARNm policistrónico). Estos genes pueden codificar proteínas estructurales, o proteínas enzimáticas o simplemente transcribirse a ARNr o ARNt.
La función controladora de la proteína reguladora se ejerce por su interacción con secuencias específicas al comienzo del operón, cerca del promotor. Estas secuencias son, pues, elementos que actúan en cis dentro del circuito regulatorio: esto significa que su efecto depende de que estén ligadas genéticamente con los genes estructurales que van a ser sometidos a control genético. Son secuencias que no codifican productos difusibles que pudieran actuar a distancia.
¿Cómo se puede distinguir y discriminar entre las funciones de un regulador que actúa en trans (a distancia) de una secuencia en cis? Esto se puede lograr a partir de la observación de los efectos fenotípicos de sus respectivas mutaciones y de los tests de complementación (aunque las bacterias son haploides, se pueden realizar ensayos de complementación génica en diploides parciales por medio de algún sistema de transferencia genética, como por ejemplo el uso de conjugación con factores F-primas (F'): véase tema 18):
1) La mutación inactivante de un gen regulador tiene efectos recesivos en trans y pleiotrópicos, que varían según que el control sea de tipo positivo o negativo:
a) en el caso de control negativo, la mutación tiene efectos constitutivos;
b) en el caso de control positivo, la mutación tiene efectos ininducibles.
2) La mutación de un operador tiene efectos dominantes en cis.
3) Por otro lado, la inactivación mutacional de un gen estructural simplemente priva a la célula de la función correspondiente.
Comparemos ahora las regulaciones genéticas de tipo positivo y negativo:
1) Control negativo: el sistema se expresa a menos que sea desconectado por la acción de una proteína reguladora, a la que se denomina represor. Dentro de este control podemos distinguir, a su vez:
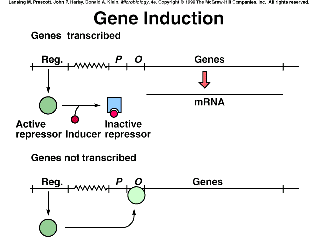
a) Control negativo con efectos inductores (ej: en el operón lac): el represor, per se es activo, pero se inactiva en presencia del inductor.
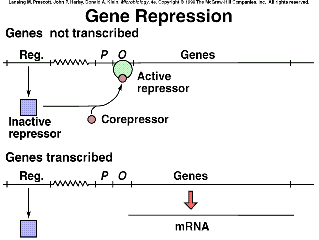
b) Control negativo con efectos represores (ej: en el operón trp): el represor, per se es inactivo (aporrepresor), pero en presencia del correpresor se activa (adquiere su capacidad funcional), y es entonces cuando reprime al operón estructural.
2) Control positivo: los genes estructurales no se transcriben (o en todo caso lo hacen a un nivel basal bajo) a no ser que exista una proteína reguladora activa llamada apoinductor o activador. También aquí puede haber dos categorías:
a) Control positivo por inducción: la proteína activadora, por sí misma es inactiva, pero queda activada cuando se le une el inductor.
b) Control positivo por represión: la proteína activadora, per se, es activa, pero se inactiva cuando se le une el correpresor.
 |
 |
|
Control negativo con inducción |
Control negativo con represión |
Obsérvese, pues, que el estado activo del operón varía según que se trate de un sistema inducible o reprimible:
|
en los sistemas inducibles, el estado activo es el inducido; | |
|
en los sistemas reprimibles, el estado activo es el desreprimido. |
Iniciamos ahora el estudio de los controles genéticos en un sistema paradigmático: el operón lac (metabolismo de la lactosa) del colibacilo (Escherichia coli), que históricamente fue el primero en investigarse (por Jacob y Monod, años 50, y que les hizo ganar el premio Nobel en 1965). En este epígrafe abordaremos el comportamiento de este operón bajo regulación negativa (incorporando detalles ulteriores al trabajo de Jacob y Monod). Más adelante (2.1.2.3), veremos que el operón lac también posee un control positivo.
El operón lac, está constituido por:
|
tres genes estructurales:
| |||||||
|
un promotor para la unión de la holoenzima de la ARN polimerasa | |||||||
|
un elemento regulador en cis: el operador, parcialmente superpuesto con el promotor |
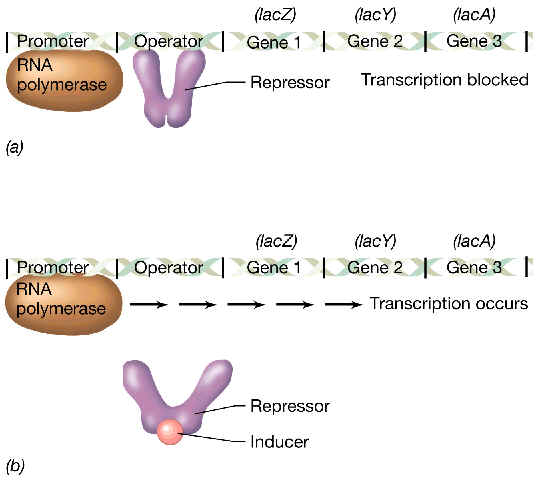
Este operón está controlado por el producto de un gen situado cerca del operón (pero que no forma parte de él; este es el elemento regulatorio en trans): el gen lacI, que codifica un represor que por sí mismo es activo como tal. El polipéptido de 38 kDa producido por este gen se agrega espontáneamente formando tetrámeros, que son la forma funcional del represor.
Veamos el funcionamiento del sistema:
|
Mientras en el medio no exista lactosa, el tetrámero del represor presenta una alta afinidad de unión hacia las secuencias del operador, y así impide que la ARN polimerasa reconozca y se una al promotor; por lo tanto, no existe apenas transcripción del operón de la lactosa. La actividad de unión al operador reside en el extremo N-terminal, que presenta un diseño característico en hélice-bucle-hélice. El operador al que se une presenta una secuencia palindrómica imperfecta. | |
|
Si en el medio existe lactosa (u otro azúcar de tipo ß-galactósido) como única fuente de C, dicho azúcar actúa como inductor del operón: se une a una zona de las subunidades del tetrámero del represor (codificado por lacI), con lo que se produce un cambio conformacional alostérico del represor; con ello disminuye la afinidad del tetrámero hacia la secuencia del operador, por lo que ahora la ARN polimerasa puede iniciar la transcripción. El represor inactivo “emigra” a zonas inespecíficas y aleatorias del ADN, distintas del operador. |
Algunas ideas adicionales
|
En realidad el inductor natural no es exactamente la lactosa, sino el isómero alolactosa, que se origina nada más entrar aquella a la célula. | |
|
En el laboratorio se suelen emplear los llamados inductores gratuitos: se trata de moléculas artificiales (aunque b-galactósidos) que si bien pueden interaccionar con el represor, no pueden ser metabolizadas (a diferencia de la lactosa). Un ejemplo es el llamado IPTG (isopropil-b-D-tiogalactósido). | |
|
Se ha visto que el operón lac tiene de hecho tres secuencias de tipo operador. La denominada O1 es la “clásica”, parcialmente superpuesta con el promotor, pero también hay que contar con la O2, centrada hacia la coordenada +440 del ARNm, y la O3, bastante aguas arriba respecto del promotor (centrada hacia -82). Se ha propuesto que los tetrámeros del represor reconocen simultáneamente dos de estas secuencias, obligando al ADN a curvarse de modo pronunciado, evitando así que pueda actuar la ARN-polimerasa. | |
|
En Ingeniería genética se suele usar a menudo algún componente del operón lac. Por ejemplo, se puede recurrir al promotor lac (bien sea en su versión silvestre o en algún mutante) para lograr la expresión de ciertos genes. Uno de los usos más extendidos es el del gen lacZ, determinante de la b-galactosidasa. Cuando las células de Escherichia coli silvestres respecto de lacZ crecen en presencia del X-gal (un galactósido artificial), las colonias tiene un aspecto azul, debido a que la b-galactosidasa transforma dicho X-gal en una sustancia de color azul. Pero si el gen lacZ está inactivado (p. ej., porque tenga una delección o una inserción), las colonias son de color blanco. |
Este tipo de dispositivo regulador es propio de rutas catabólicas, donde el principio de economía debe garantizar que las enzimas de la ruta sólo se induzcan en presencia del sustrato adecuado.
La regulación negativa y reprimible es muy apropiada y económica para “desconectar” la transcripción de los genes de rutas biosintéticas de intermediarios metabólicos (como aminoácidos, bases nitrogenadas y vitaminas) cuando los productos finales de estas rutas están disponibles a la bacteria a partir del medio de crecimiento. En estos sistemas, a diferencia de la regulación de operones catabólicos, la proteína reguladora es inactiva en sí misma, por lo que recibe el nombre de aporrepresor. El efector que desencadena la represión se denomina correpresor, y suele ser la sustancia del medio equivalente al producto final de la ruta biosintética. La unión del correpresor con el aporrepresor genera un complejo denominado represor activo.
El operón trp de Escherichia coli está compuesto por:
|
Cinco genes estructurales en la secuencia trpEDCBA. Codifican cinco polipéptidos que a su vez constituyen tres enzimas implicadas en el paso de corísmico a triptófano. | |
|
Promotor | |
|
Operador (superpuesto al promotor). |
A la zona del operador se pueden unir dímeros del elemento regulatorio en trans: un represor codificado por el gen trpR (que está lejos del operón estructural). Entre el promotor y el inicio del primer gen estructural existe una zona regulatoria compleja (líder más atenuador) que interviene en un tipo de regulación distinta que estudiaremos más adelante (atenuación). (Como ya dijimos, son muy frecuentes los sistemas genéticos sometidos a varios niveles de regulación).
Así pues, en esta apartado consideraremos sólo el funcionamiento del sistema trp en cuanto al mecanismo de represión-desrepresión:
|
En un medio pobre en aminoácido triptófano: el gen trpR se expresa: se sintetiza el aporrepresor inactivo, por lo que la ARN polimerasa puede transcribir el operón de genes estructurales (trpEDCBA). Hay síntesis de las enzimas del operón a sus niveles desreprimidos. | |
|
En un medio rico en triptófano: el gen trpR se expresa igualmente, es decir, se sintetiza aporrepresor inactivo, pero al unirse a dos moléculas de triptófano que la bacteria ha captado del medio se produce un cambio de conformación que genera el represor activo (aporrepresor + correpresor): ahora reconoce y se une a la secuencia del “operador” (que está solapado con el promotor). Así se impide la transcripción del operón, aunque no totalmente. Esto da lugar al nivel de expresión basal o reprimido (que en el caso de este operón representa 1/60 del nivel desreprimido). |
Además, en medio rico en triptófano, el gen regulador trpR se ve reprimido por su propio producto (aporrepresor + triptófano). Estamos ante un ejemplo de regulación autógena: el nivel de represor está autocontrolado:
|
Si existe demasiado represor, se impide la síntesis de más represor; | |
|
Si existe poco represor se posibilita la transcripción del gen trpR. |
Algunos operones bacterianos poseen promotores tales que no pueden ser usados eficientemente por la ARN polimerasa de forma directa para el inicio de la transcripción, sino que además, requieren proteínas auxiliares activadoras. Es decir, la transcripción de estos operones no ocurre (o en todo caso ocurre a un nivel basal bajo), a no ser que la proteína activadora se una a zonas del ADN cercanas al promotor (normalmente al lado 5' respecto del promotor). Este tipo de promotores carecen de las secuencias típicas -35 y -10 a las que ya hemos aludido anteriormente.
Como ejemplo de regulación positiva del inicio de transcripción estudiaremos la que existe en el operón lac de E. coli:
| Para comenzar, veamos el comportamiento de una población de esta bacteria cuando en su medio de cultivo existen dos fuentes de carbono: glucosa y lactosa: se da un crecimiento en dos fases llamado crecimiento diáuxico: durante una primera fase, las bacterias aprovechan solamente la fuente más rica de carbono (la glucosa), creciendo de modo exponencial durante unas cuantas generaciones, hasta que agotan esta glucosa. A continuación se entra en una corta fase de tipo estacionario, que conduce a una nueva fase de crecimiento exponencial (aunque con un coeficiente m menor que el de la fase exponencial anterior) debido a que en ésta las bacterias han pasado a metabolizar la lactosa. Mientras exista glucosa en el medio de cultivo, no se degrada la lactosa, debido al fenómeno conocido como represión catabólica o “efecto glucosa”: el catabolismo de la glucosa “impide” de alguna manera que se expresen los genes del operón de la lactosa. Pero una vez que la glucosa se agota, el operón lac se activa y se expresa: se sintetizan las enzimas que permiten metabolizar la lactosa. La corta fase estacionaria representa entre las dos exponenciales representa el tiempo que tardan las bacterias en “conectar” y expresar los genes del catabolismo de la lactosa una vez agotada la glucosa. |
|
El nombre de “represión catabólica” se puso en un momento en el que se desconocía la base molecular de su funcionamiento. A pesar de que sigamos usando este nombre por motivos históricos, hoy sabemos que este fenómeno es la manifestación de un proceso de regulación genética positiva. A continuación pasamos a describirlo a nivel molecular:
En breves palabras, lo que ocurre es que en presencia de una fuente preferencial de carbono (como es la glucosa) el mecanismo de regulación positiva del operón lac se inactiva. Por contra, en ausencia de glucosa y en presencia de la lactosa, este mecanismo positivo es funcional, lo que permite la estimulación del inicio de la transcripción del operón.
Elementos del circuito regulatorio:
|
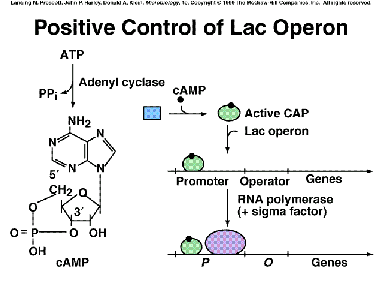
gen crp: codifica la proteína regulatoria, un polipéptido que forma espontáneamente dímeros, constituyendo la denominada proteína relacionada con la represión catabólica (CRP), también conocida como proteína que une AMPc (CAP). Tal como es sintetizada por el gen crp, la proteína CAP es inactiva (apoinductor inactivo). Pero cuando la bacteria posee niveles adecuados de AMPc (que actúa como inductor endógeno), éste se une a la CAP, lo que conduce a que el dímero cambie de conformación: en esta nueva configuración el complejo CAP-AMPc reconoce una secuencia palindrómica cercana al promotor del operón lac (hacia su lado 5'), y actúa como activador del inicio de transcripción de este operón. | |
|
gen cya: codifica la adenilato-ciclasa, enzima que convierte el ATP en AMPc. | |
|
operón lac: a la descripción que ya dimos, solamente añadir que a la izquierda (o sea, al lado 5' o “aguas arriba”) del promotor existe una secuencia palindrómica característica, que como acabamos de ver es el lugar de reconocimiento del complejo activador CAP-AMPc. |
Veamos, pues, el funcionamiento del circuito regulatorio:
|
Ante todo, hay que tener presente que el nivel intracelular de AMPc está en relación inversa con la velocidad de crecimiento de la bacteria. A su vez, la velocidad de crecimiento está en relación directa con la “riqueza” de la fuente de C. | |
|
En presencia de glucosa (fuente rica de C): como se recordará (tema 6), en Enterobacterias la glucosa es transportada por el sistema de fosfotransferasa (sistema PTSGLC, un ejemplo típico de transporte activo acoplado a translocación de grupos). Como es sabido, en este sistema hay dos enzimas específicas del azúcar a nivel de membrana, que reciben secuencialmente el fosfato (P), que a su vez será transferido a la glucosa, que de esta forma entra al citoplasma. Mientras exista glucosa, el sistema PTSGLC estará funcionando, de modo que apenas habrá nivel de E-IIAGLC fosforilada, porque rápidamente el fosfato es transferido a la glucosa en su tránsito por la membrana (bajo E-IIGLC~P). Ello supone una señal que inhibe a la enzima adenilato-ciclasa. En resumen, en presencia de glucosa los niveles de AMPc son bajos. Por lo tanto, el apoinductor CAP, aunque se está sintetizando, permanece inactivo, ya que al no haber apenas AMPc no puede cambiar de conformación. Esta es la base molecular del fenómeno de “represión catabólica”: observa que en realidad no es una auténtica represión, sino que se trata de la no activación de la proteína activadora, debida en última instancia al catabolismo de la glucosa. | |
|
En ausencia de glucosa: el sistema PTSGLC no está transportando glucosa, por lo que ahora sí hay altos niveles de E-IIAGLC ~P (y bajos de la versión no fosforilada). El sistema ahora no envía la señal inhibidora de la actividad adenil-ciclasa : se sintetizan niveles elevados de AMPc. Éste se une a los dímeros de CAP (=CRP); el concomitante cambio de conformación permite al complejo CAP-AMPc reconocer su secuencia-diana palindrómica cerca del promotor de lac. En esta interacción con su secuencia-diana, la CAP obliga al ADN a curvarse unos 90o. Ahora la CAP interacciona con las subunidades a de la ARN polimerasa, de modo que ahora sí puede efectuar el inicio de la transcripción con gran eficiencia. |
Así pues, hemos completado el estudio de la regulación del operón lac. En resumidas cuentas, cabe resaltar que se trata de un operón sometido a dos tipos de controles del inicio de la transcripción:
|
regulación negativa, (represión en ausencia de lactosa, pero inducción en presencia de lactosa) | |
|
regulación positiva, por activación (en ausencia de glucosa y con lactosa presente) |
Por lo tanto, el operón lac, para que pueda transcribirse a pleno rendimiento requiere que se cumplan dos condiciones simultáneamente:
1. No debe haber en el medio una fuente más rica de azúcar (como la glucosa), lo que libera la “represión catabólica” por el mecanismo de regulación positiva a través de CAP
2. Debe existir el inductor exógeno (la lactosa), que inactiva el mecanismo de regulación negativa.
En Enterobacterias, lo que acabamos de describir para el operón lac lo podemos hacer extensivo a otros muchos operones (que comprenden más de 300 genes) correspondientes al catabolismo de otras fuentes de C más pobres que la glucosa. Es decir, mientras exista glucosa en el ambiente de la bacteria, ésta será usada en primer lugar, de modo que mientras se metaboliza está operando el fenómeno de “represión catabólica”. Pero una vez agotada, y suponiendo que exista una fuente alternativa de C, ésta pasará a ser usada, merced a la activación genética mediada por el complejo CAP-AMPc.
Ejemplos de otros operones controlados positivamente por CAP-AMPc:
|
operón ara (del catabolismo de la arabinosa); | |
|
operón gal (del catabolismo de la galactosa); | |
|
operón mal (del catabolismos de la maltosa). |
Este conjunto de operones diferentes que están regulados por la proteína CAP se denomina regulón CAP.
En otras bacterias el fenómeno de represión catabólica no depende de AMPc-CAP, sino que la regulación positiva de operones catabólicos de azúcares distintos de la glucosa está mediada por proteínas activadoras diferentes.
No podemos olvidar aquí un tipo de operones transcribibles por holoenzimas de la ARN-polimerasa con subunidades s alternativas a la estándar s70 que requieren para su transcripción eficiente la colaboración de proteínas activadoras especiales que reconocen secuencias de ADN situadas a bastante distancia aguas arriba respecto del respectivo promotor. Por ejemplo, en muchas bacterias Gram-negativas hay operones con un tipo de promotor especial (cuyas secuencias conservadas, centradas en -24 y -12 son diferentes a las citadas hasta ahora) reconocido sólo por la versión de la ARN-polimerasa provista de la subunidad s54. Pues bien, para la transcripción de este tipo de operones (llamados ntr) se requiere la concurrencia de la proteína reguladora NtrC fosforilada, que reconoce una secuencia palindrómica a unas 100 pb aguas arriba del promotor. Al parecer, la unión de oligómeros de NtrC~P a sus secuencias de reconocimiento hace que el ADN se curve, de modo que esas NtrC~P hacen contacto con la ARN-polimerasa, y tras gastar ATP ayudan en el inicio de la transcripción.
La atenuación es un mecanismo de control que se da en ciertos operones de rutas biosintéticas (sobre todo de aminoácidos), por el cual una onda de transcripción recién iniciada puede terminar prematuramente en una zona denominada atenuador, antes de alcanzar al primer gen estructural de ese operón. A nivel de ADN, el atenuador está situado entre el promotor y el inicio del primer gen estructural, dentro de la porción que a nivel de ARN representa al “líder”. A diferencia de los mecanismos de regulación que hemos visto en la sección anterior, la atenuación no depende de proteínas reguladoras.
La atenuación se produce por un control ejercido por la traducción, que a su vez responde al nivel intracelular del ARNt cargado con el aminoácido de la ruta biosintética en cuestión:
|
si existe suficiente nivel de ese aa-ARNt, habrá atenuación de la transcripción; | |
|
si no existe suficiente de ese aa-ARNt, no habrá atenuación, y por lo tanto la transcripción continuará hasta el final. |
La presencia o ausencia del aa-ARNt concreto determina si el ribosoma puede traducir, o no, una zona temprana del ARNm (dentro de la porción del líder): si el ribosoma puede traducir esa zona (porque existe nivel de ese aa-ARNt), el avance del ribosoma detrás de la ARN polimerasa impide ciertos emparejamientos intracatenarios dentro del ARNm naciente, pero permite otros emparejamientos alternativos de modo que se forma una estructura secundaria de tipo terminador simple (independiente de r). Por lo tanto la ARN- polimerasa se atranca en esta horquilla y finalmente se separa, deteniéndose así la transcripción antes de que la onda de transcripción haya alcanzado al primer gen estructural.
Mecanismo molecular de la atenuación: lo estudiaremos con el caso del operón de la biosíntesis del triptófano (trp), el primero en investigarse (por Yanofsky).
Descripción del operón trp (consultar figura): observa la zona del promotor-operador (sobre la que ya vimos en un apartado anterior que se ejerce un mecanismo de control negativo por represión); observa la secuencia líder, al comienzo del ARNm, antes de la porción codificadora del primer gen (trpE). Este líder consta de 162 bases, y en su interior alberga una corta región con capacidad potencial de ser traducida por ribosomas (es decir, un marco abierto de lectura u ORF según sus iniciales inglesas): nótese que el péptido que se sintetizaría a partir de esta porción es rico en trp, es decir, tiene una alta proporción del mismo aminoácido objeto de la síntesis dependiente del operón trp.
Como ya dijimos antes, la clave de la regulación estriba precisamente en el líder (incluyendo la porción del péptido rico en triptófano). La porción de ARNm correspondiente al líder forma parte de una zona que puede adoptar estructuras secundarias distintas y alternativas, debido a la posibilidad de establecer emparejamientos intracatenarios:
|
bien se emparejan la zona 1:2 y la 3:4; | |
|
o bien se empareja la 2:3, quedando la 1 y la 4 sin emparejar. |
Pues bien, la estructura en horquilla formada por el emparejamiento de 3:4 constituye un típico terminador de la transcripción independiente de r.
Pasemos, pues, al funcionamiento del mecanismo de atenuación:
| Si existe suficiente triptófano en el medio: la bacteria capta triptófano, y sintetiza el triptofanil-ARNt (ARNttrp); habrá reserva suficiente de este ARNttrp como para poder ser usado normalmente en la síntesis de proteínas. La ARN polimerasa va transcribiendo el operón trp, y detrás de ella los ribosomas comienzan a cubrir la zona del péptido dentro de líder del ARNm. Tras traducir la porción 1 del líder, el ribosoma cubre enseguida y traduce la porción 2. Mientras tanto, la ARN-polimerasa acaba de transcribir las porciones 3 y 4. La porción 3 se empareja espontáneamente con la 4. (Observa que a la porción 3 no le queda más remedio, ya que la porción 2, con la que teóricamente también puede emparejarse no está disponible, ya que está “oculta” -cubierta- por el ribosoma). Consecuencia: al formarse la horquilla 3:4, seguida por la ristra de uracilos (U), se constituye un típico terminador de transcripción independiente de r: se termina prematuramente la transcripción (antes de que la onda de transcripción haya alcanzado al primer gen estructural, trpE): este es precisamente el fenómeno de atenuación. |
|
| Si el triptófano es limitante en el medio: la bacteria dispondrá de pocos ARNt cargados on el aminoácido triptófano (o sea, el “pool” intracelular de ARNttrp estará a bajos niveles). El ribosoma, al llegar a los codones de triptófano dentro de la porción codificadora del líder, se quedará “atrancado”, debido a que no encuentra el ARNttrp que introduzca el triptófano frente a dos codones seguidos para ese aminoácido. El ribosoma se queda, pues, detenido en la porción 1. Mientras tanto, la ARN polimerasa “le va sacando ventaja” al ribosoma, de modo que transcribe la porción 2, luego la porción 3... pero antes de terminar con la porción 4, la 2 y la 3 se emparejan entre sí (de modo que es ahora la 4 la que se queda sin emparejarse). Esto implica que ya no se puede formar la estructura secundaria 3:4 seguida de varios U: por lo tanto, no hay terminación de la transcripción, sino que ésta continúa y abarca a todo el operón trp, y finalmente se sintetizan las enzimas biosintéticas que conducirán a la síntesis del aminoácido triptófano. |
|
Otros casos de atenuación:
La atenuación es un sistema de control genético de una amplia variedad de operones biosintéticos, especialmente de aminoácidos. Otros ejemplos descubiertos después del sistema trp:
|
operón his: síntesis de histidina | |
|
operón phe: síntesis de fenilalanina; | |
|
operón leu: síntesis de leucina; | |
|
operón thr: síntesis de treonina; | |
|
operón ilv: síntesis de isoleucina y de valina. |
Algunos de estos operones (como el his) sólo poseen atenuación como mecanismo de control, mientras que otros gozan, además de regulación por represión.
Los ARNm de cada uno de estos operones posee en su inicio una porción líder más o menos larga, pero con las características que ya hemos visto:
|
|
|
el líder del ARNm puede formar estructuras secundarias alternativas, incluyendo un atenuador (es decir, una estructura en horquilla seguida de ristra de uracilos, que actúa como un poderoso terminador prematuro de la transcripción). |
En resumen: La atenuación es un mecanismo que permite detectar los bajos niveles intracelulares del aminoácido en cuestión (bajo la forma de aminoacil-ARNt), los cuales dependen a su vez de bajos niveles del aminoácido en el medio, de modo que la bacteria responde a las necesidades inmediatas de ese aminoácido (que se requiere para la síntesis proteica). El mecanismo estriba en la capacidad o incapacidad del ribosoma para atravesar la región líder, lo que a su vez determina la formación de estructuras secundarias alternativas en el líder. Como se puede constatar, la atenuación es un mecanismo que depende totalmente del estrecho acoplamiento que existe en bacterias entre transcripción y traducción.
Los sistemas de regulación que hemos estudiado hasta ahora se ponen en marcha cuando un estímulo ambiental químico, normalmente una pequeña molécula relacionada con el metabolismo (el efector), entra en la célula e interacciona con una proteína reguladora, que a su vez se une (o deja de unirse) con una secuencia de ADN al comienzo del operón. Pero hace relativamente pocos años se descubrió que las bacterias poseen también numerosos sistemas en los que la señal ambiental no entra a la célula, sino que es detectada por un “sensor” a nivel de membrana, el cual “reemite” (transduce) el estímulo hacia una proteína citoplásmica, la cual a su vez interacciona con secuencias determinadas al comienzo del operón, para regularlo, generando así la respuesta adaptativa correspondiente a la señal ambiental. Como en la mayor parte de los casos el sistema funciona con dos proteínas (la sensora y la reguladora), a este tipo de sistemas se los conoce con el nombre de sistemas de regulación de dos componentes.
Los distintos sensores, a pesar de que cada uno detecta un estímulo diferente, se parecen entre sí en al menos parte de su secuencia, y lo mismo ocurre con los reguladores de respuesta, por lo que se habla de dos familias de proteínas (cada una con un probable origen evolutivo común):
1. Familia de histidín-proteín-quinasas (HPK): Este tipo de proteínas son las sensoras de algún tipo de estímulo ambiental. Muchas de ellas son autofosforilables, pero su función esencial es la de fosforilar al correspondiente segundo miembro de la pareja (el regulador). Los distintos sensores suelen tener en común su porción carboxiterminal, denominada dominio transmisor (que incluye la histidina fosforilable). Los sensores suelen ser proteínas integrales de membrana citoplásmica. Cada sensor tiene un dominio aminoterminal característico, inmerso en el espacio periplásmico, y de este modo “detectan” algún estímulo procedente del ambiente. Al hacerlo, parece que cambian de conformación, de modo que el dominio transmisor intracitoplásmico se autofosforila y luego fosforila al correspondiente regulador de respuesta.
2. Familia de reguladores de respuesta (RR): cada regulador de respuesta, tras ser fosforilado en cierto aspártico por su correspondiente HPK, ejerce algún efecto regulatorio. Normalmente, los RR fosforilados actúan como activadores de la transcripción de ciertos operones. Los distintos reguladores comparten un mismo tipo de dominio aminoterminal, denominado dominio receptor, que incluye el aspártico que recibe el fosfato del sensor correspondiente. Los reguladores que actúan como activadores de transcripción suelen incluir un dominio carboxiterminal a base del típico motivo hélice-giro-hélice, capaz de interactuar con ciertas secuencias de ADN.
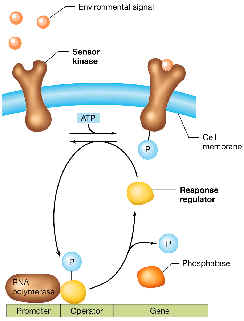
Los sistemas de dos componentes son muy abundantes en bacterias. Por ejemplo, en E. coli se han descubierto unos 50, entre los cuales podemos citar:
|
Sistema Ntr de utilización de fuentes de nitrógeno, que responde ante los niveles de amonio, y que permite el uso de fuentes alternativas de nitrógeno. | |
|
Sistema de respuesta ante osmolaridad: el aumento de presión osmótica es detectado por la HPK sensora llamada EnvZ, que fosforila al regulador OmpR. A su vez, este regulador controla las proporciones relativas de dos porinas, OmpC y OmpF, haciendo que predomine la porina de poro más pequeño (OmpC). |
Para finalizar este recorrido por los principales tipos de mecanismos de regulación de la expresión génica en bacterias, vamos a referirnos brevemente a algunos ejemplos de grandes sistemas de operones que se ven sometidos a una regulación coordinadada común, encaminada a la superviviencia de la bacteria en determinadas circunstancias ambientales extremas o a realizar grandes ajustes metabólicos para adaptarse a cambios bruscos en las condiciones nutricionales.
Repasemos algo que ya vimos en el capítulo 13 (“Influencia de los agentes físicos sobre las bacterias”): en determinados procariotas existe un sistema inducible de reparación a los daños severos al ADN ocasionados por agentes como la luz UV o las sustancias alquilantes. Los genes SOS se desreprimen según el siguiente esquema:
Cuando el ADN de la bacteria está seriamente dañado, existen zonas de ADN de cadena sencilla sin reparar. Esto constituye una señal por la que la proteína RecA (que está en este momento a una concentración basal relativamente baja) se modifica y se convierte en una proteasa muy específica (RecA*): la RecA* rompe a la proteína LexA, que estaba reprimiendo una serie de operones, incluyendo a recA, uvrABC, umuDC, etc. Por lo tanto, estos genes se expresan ahora a alto nivel:
|
la expresión de uvrABC induce una mejora de la reparación por escisión resíntesis; | |
|
la expresión de recA mejora la reparación por recombinación; | |
|
la expresión de umuDC favorece una síntesis “de emergencia” de ADN, por la que se introducen frecuentes errores: hay aumento de la mutagénesis; | |
|
se altera la regulación del crecimiento y división celular: las células se hacen filamentosas, muy largas, con formas anómalas. |
Todos estos cambios, a pesar de las alteraciones que provocan en las células, suponen la salvaguardia, en última instancia de su viabilidad. Cuando las circunstancias agresivas (UV) desaparezcan, el mismo circuito regulador se encarga de que las células vuelvan rápidamente a su metabolismo normal.
La llamada respuesta al choque térmico es un mecanismo adaptativo compartido por prácticamente todos los seres vivos, consistente en el aumento rápido de la síntesis de una serie de proteínas (denonimadas proteínas Hsp, iniciales del inglés heat shock proteins) ante la elevación brusca de la temperatura por encima de la óptima, con un ulterior descenso lento a sus niveles basales. A pesar de que esta respuesta se descubrió precisamente ante aumentos de temperatura, se sabe ahora que en realidad se induce ante otros tipos de agresiones o estrés ambientales (como por ejemplo, presencia de etanol u otros solventes orgánicos en el medio, o daño al ADN). Las proteínas Hsp protegen a las células del daño que les causaría una posterior elevación adicional de la temperatura. Obviamente, este sistema parece que constituye un mecanismo adaptativo de protección que, una vez que detecta incrementos anómalos de temperatura, prepara a la bacteria para soportar períodos relativamente largos a temperaturas por encima de la óptima de crecimiento.
En Escherichia coli la mayor parte de los 36 genes codificadores de proteínas Hsp forman un regulón, y los correspondientes operones son transcritos por la versión de la ARN-polimerasa provista de la subunidad s32.
La mayor parte de las proteínas Hsp se expresan a niveles basales durante el crecimiento normal, pero tras la agresión ambiental, aumentan abruptamente y luego vuelven lentamente al nivel normal (aun cuando p. ej., la temperatura siga alta). Algunas de las Hsp son proteínas celadoras (“chaperonas”; véase tema 7) que intervienen en el plegamiento adecuado de otras proteínas. Entre estas celadoras se encuentran GroE, DnaK, DnaJ y GrpE. Otras Hsp son proteasas (como la Lon) que degradan proteínas demasiado anómalas. Estos papeles de las proteínas Hsp explican por qué la respuesta al choque por calor es transitoria:
|
Inmediatamente después de la agresión ambiental, las proteínas, al no tener las concentraciones de sales y otros componentes adecuados a su estabilidad, tienden a desnaturalizarse. La respuesta adaptativa viene enseguida, aumentando los niveles de proteínas celadoras (que ayudan a replegarse a las proteínas defectuosas, parcialmente desnaturalizadas) y de proteasas (que eliminan proteínas inútiles desnaturalizadas). | |
|
Pero una vez que ha pasado un tiempo, el medio interno de la célula ya se ha adaptado a las nuevas condiciones, por lo que ya no hace falta un nivel tan alto de Hsp, por lo que la respuesta va remitiendo. |
Los operones del regulón del choque por calor se transcriben a partir de promotores especiales (con su propia secuencia consenso) cuando son reconocidos por la holoenzima de la ARN-polimerasa con la subunidad s32. Durante el crecimiento en condiciones normales, hay muy pocas moléculas de s32 en la célula, debido a que se degrada rápidamente (en uno o dos minutos), pero cuando sube la temperatura de 30 a 42 ºC, los niveles suben 15 veces, de modo que aumenta la transcripción de los genes del choque térmico. Al parecer, esos niveles de s32 vienen regulados postraduccionalmente por alguna de las propias chaperonas.
El modelo actual dice lo siguiente:
|
en condiciones normales las proteínas celadoras (chaperonas) DnaK, DnaJ y GrpE se unen a polipéptidos nacientes ayudándoles a plegarse adecuadamente. Pero por otro lado, la DnaK se une también a la poca s32, de modo que ésta no sólo no puede ayudar al inicio de transcripción de los operones Hsp, sino que además queda inestabilizada y es más susceptible de ataque por proteasas. | |
|
Cuando hay un choque por calor, al cambiar bruscamente las condiciones del medio celular, las proteínas en general tienden a desnaturalizarse, por lo que en un primer momento las chaperonas se dedican a intentar replegar correctamente el mayor número de proteínas. Esto significa que ahora la DnaK tiende preferentemente a unirse a proteínas diferentes del factor s32. Por lo tanto, la s32 intacta se va acumulando en la célula e incrementa su actividad, y se puede producir el aumento de expresión de los operones Hsp, incluyendo el mismo dnaK. Esto explica igualmente el fenómeno ya comentado de que la expresión de las Hsp va volviendo poco a poco a su nivel basal: cuando se ha acumulado una buena cantidad de DnaK suficiente para ayudar a replegarse a las proteínas celulares, y cuando ha dado tiempo a que las condiciones internas se ajusten a las condiciones del estrés ambiental, vuelve a haber DnaK “libre” como para volver a unirse a la s32, de modo que lentamente se vuelve al nivel normal de transcripción de los genes de las proteínas del choque térmico. |
Hace unos pocos años se descubrió en eubacterias un nuevo tipo de mecanismo regulador, cuya señal desencadenante depende de que las bacterias correspondientes alcancen en su medio una densidad celular umbral. Por ello se le ha dado el nombre de “quorum sensing” (percepción del quórum o autoinducción). Este mecanismo implica una comunicación y “colaboración” entre multitud de individuos de la misma especie para dar una respuesta coordinada baja determinadas circunstancias ambientales.
El mecanismo general consiste en lo siguiente: Mientras las bacterias están creciendo, van sintetizando una pequeña molécula sensora (autoinductora), que difunde al medio exterior, de modo que cuando llega a tener una determinada concentración, indica a la población de esa bacteria que ha alcanzado un cierto nivel crítico o umbral (quórum), con lo que pone en marcha la respuesta adaptativa. Esto garantiza que la respuesta de la población se produzca en el momento adecuado, y no antes, ya que la eficiencia de la respuesta depende de la población como tal y no de las células aisladas o en pequeños grupos. Por ejemplo, la eficacia de la respuesta adaptativa de ciertas bacterias puede depender de la secreción de ciertas enzimas a cierto nivel alto; tal nivel se garantiza una vez que la población bacteriana llega a una concentración alta, y para ello las bacterias necesitan “saber” que han alcanzado dicha concentración, precisamente debido a que detectan un nivel alto de la propia molécula sensora que han estado produciendo y secretando.
El mecanismo se ha estudiado mejor en bacterias Gram-negativas. En estas, las pequeñas moléculas sensoras-inductoras son lactonas de homoserina acilada (LHA), consistentes en una cadena acílica C4 a C14 unida por enlace amido a una homoserina-lactona. Al parecer, la LHA puede difundir libremente entre ambos lados de la membrana. Cuando el cultivo alcanza una cierta densidad (es decir, se alcanza el quórum), la concentración externa de LHA es suficiente para que a su vez se logre un nivel interno de la misma en cada individuo, lo que permite su unión a una proteína activadora; entonces esta proteína cambia su conformación y ejerce su papel activador sobre los correspondientes operones, que al expresarse, producen proteínas dependientes de quórum, responsables de la respuesta de adaptación al medio en la población. El gen responsable de la síntesis de la LHA forma parte a su vez del operón inducido, por lo que aquí nos encontramos con un bucle autoinductor que se amplifica a sí mismo (una especie de efecto “bola de nieve” genético).
|
El primer ejemplo descubierto de “quorum sensing” fue la regulación de la bioluminiscencia en la bacteria marina Vibrio fischeri, que vive simbióticamente en órganos especiales de ciertos calamares (como p. ej., el hawaiano Euprymna scolopes) y peces. El operón lux está implicado en la formación del enzima luciferasa, responsable de que estas bacterias emitan luz en presencia de oxígeno. Pero esta luminiscencia sólo se pone en marcha cuando hay una concentración suficiente de bacterias. Al principio del crecimiento, las bacterias no emiten luz (porque el operón estructural lux no se expresa), pero están produciendo y secretando al medio una lactona de homoserina acilada, codificada por el gen luxI. Cuando esta LHA alcanza un nivel suficiente (al llegarse a cierta densidad celular en la que la concentración de la LHA se equilibra entre el exterior y el citoplasma), se une a una proteína reguladora codificada por el gen luxR, y el complejo activa a los genes lux, entre los cuales está el que codifica la luciferasa, de modo que se manifiesta la bioluminiscencia.[1] | |||||||||
|
En la bacteria patógena oportunista Pseudomonas aeruginosa (que puede ser peligrosa en grandes quemados o en pacientes con catéteres), la percepción de quórum interviene en la formación de biopelículas sobre superficies, donde las bacterias están más protegidas. Y además, el quórum sensing está implicado en el desencadenamiento de los mecanismos de patogénesis para atacar los tejidos del hospedador o paciente. | |||||||||
|
En bacterias Gram-positivas la pequeña molécula sensora del quórum suele ser un oligopéptido previamente secretado por los individuos. Ejemplos de quórum sensing en Gram-positivas:
|
![]()
[1] El operón de genes de la bioluminiscencia de Vibrio fischeri está, además sometido a “represión catabólica”, es decir, su expresión en bajos niveles de glucosa depende también de la proteína CAP (CRP). Esto nos recuerda, una vez más, que a menudo los operones bacterianos poseen dos o más sistemas superpuestos de control genético.
![]()