La mayor parte de los procariotas posee una pared celular (P.C.) rígida
rodeando al protoplasto. Las excepciones son los micoplasmas (dentro del dominio
Bacteria) y algunas arqueas, como Thermoplasma.
Al microscopio electrónico se puede observar como una capa en íntimo
contacto con la membrana citoplásmica, con un espesor que oscila entre 10 y 80
nm (según especies) -frente a los 8 nm de la membrana celular- , y con una
estructura más o menos compleja, según los tipos bacterianos.
a)
Las paredes celulares más frecuentes en eubacterias siguen dos modelos
alternativos que, como veremos comparten un componente común: paredes de tipo
Gram-positivo o de tipo Gram-negativo.
b)
Unas pocas eubacterias (como las del gén. Planctomyces) poseen paredes a base de proteínas.
c)
Las Arqueas poseen paredes diferentes a las de eubacterias y se pueden
agrupar en diversos tipos.
El grueso de este capítulo está
dedicado al estudio de las paredes Gram-positivas y Gram-negativas, con sus
principales variantes, pero finalizaremos con una alusión a los principales
modelos de paredes arqueanas.
Aunque el alumno realizará en prácticas de labororatorio la tinción de
Gram, vamos a explicarla aquí brevemente. La tinción de Gram es la más
importante entre las tinciones llamadas diferenciales (aquellas que no tiñen de
la misma manera a todos los tipos de bacterias). Resumiendo, esta tinción
consta de varios pasos:
 |
1.
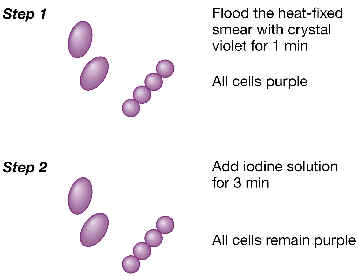
Imaginemos un frotis en porta de vidrio con una muestra de varios
tipos de bacterias, que se han fijado por calor. En la primera fase, esta
preparación de trata con un primer colorante llamado violeta cristal o
violeta de genciana.
2.
A continuación se añade una solución de lugol (yodo-ioduro), que
actúa como “mordiente”, formando una laca relativamente resistente
con el violeta. En este momento todas las bacterias están teñidas de
color violeta. |
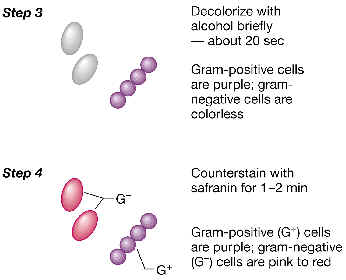 |
3.
Ahora realizamos una descoloración diferencial con etanol o una
mezcla de etanol y acetona. Lo que ocurre es que algunas bacterias (las
que llamaremos Gram-negativas) pierden el color violeta (quedarían práctimante
transparentes al microscopio), mientras que otras (las Gram-positivas)
resisten el tratamiento, y retienen el colorante violeta.
4.
Finalmente, tratamos el porta con un segundo colorante (colorante
de contraste): se trata de un colorante de color rojo o rosa, como la
fucsina o la safranina. Este colorante tiñe ahora a las bacterias
previamente descoloradas por el etanol. Por lo tanto, el resultado en la
observación al microscopio es que las bacterias Gram-positivas se ven de
color violeta, y las Gram-negativas de color rosa o rojo. |
Como veremos enseguida, esta
diferencia de comportamiento ante la tinción de Gram refleja el hecho de que
ambos tipos de eubacterias poseen dos tipos estructuralmente diferentes de pared
celular, aunque ambas posean en común la posesión de peptidoglucano. A
continuación estudiaremos con cierto detalle la pared celular de eubacterias.
|
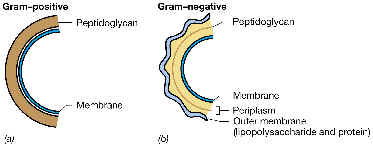
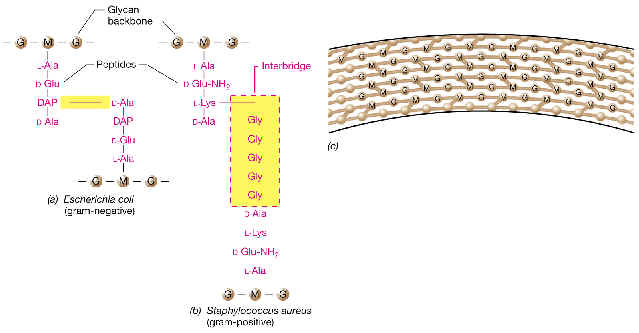
Consisten en un esqueleto macromolecular rígido, llamado peptidoglucano (= mucopéptido o mureína), que
 |
en
Gram-positivas se encuentra inmerso
en una matriz aniónica de polímeros azucarados; |
 |
y en Gram-negativas está rodeada
por una membrana externa, e inmersa en un espacio periplásmico. |
|
 |
Comenzaremos abordando esa macrolécula
tan peculiar llamada peptidoglucano, para después estudiar globalmente y por
separado la pared de Gram-positivas y Gram-negativas, con algunas variantes que
se pueden presentar.
En las bacterias Gram-positivas el peptidoglucano representa el
componente mayoritario de la pared celular (50-80% en peso), mientras que en
Gram-negativas supone sólo del 1 al 10%.
Está formado por repeticiones de una unidad disacarídica fundamental
unida a su vez a un tetrapéptido. Distintas cadenas (formadas por el esqueleto
de azúcares) se unen entre sí por determinados enlaces peptídicos entre
tetrapétidos de cadenas diferentes. Veamos todo ello en su concreción química:
La
unidad disacarídica repetitiva: consiste
en N-acetilglucosamina (NAG) unida por enlace ß(1à4)
a N-acetilmurámico (NAM). Obsérvese que el NAM es el 3-O-D-lactil-éter
de la NAG (o sea, se deriva de unir el ácido D-láctico con el OH del C-3 de la
NAG).
Las distintas unidades disacarídicas se van uniendo entre sí por
enlaces ß(1à4)
entre el NAM de una unidad y la NAG de la siguiente. Este enlace es susceptible
a la rotura catalizada por el enzima lisozima. El número de repeticiones (n)
puede oscilar entre 10 y 100.
La
cadena tetrapeptídica: Desde el grupo
carboxilo de cada ácido NAM, y mediante un enlace amido, se encuentra unido el
tetrapéptido. Un tetrapéptido típico de muchas bacterias es:
L-alanina---D-glutámico---meso-diaminopimélico---D-alanina
Obsérvese la alternancia de
aminoácidos D y L en el tetrapéptido.
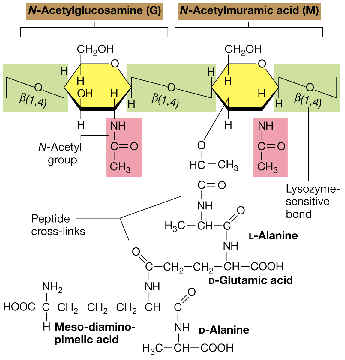
La
estructura global: Las distintas cadenas
polisacarídicas, con sus respectivos tetrapéptidos, se unen entre sí por
medio de puentes o enlaces peptídicos, entre un aminoácido de una cadena (p.
ej., el aminoácido nº3, como el meso-DAP del ejemplo) y otro aminoácido de
una cadena adyacente (la D-ala terminal). De este modo, la estructura global es una
sola macromolécula gigante que envuelve al protoplasto, formando un sáculo
rígido, a modo de tejido continuo, que tiene el volumen y la forma de la
bacteria respectiva.
 |
En bacterias Gram-negativas este sáculo
está formado por una sola capa (o unas pocas) de cadenas de PG. |
 |
En Gram-positivas existen varias
capas (hay varios niveles de PG). |
A continuación describiremos por separado el PG de Gram-positivas y
Gram-negativas, dando indicaciones de sus principales variantes.
En la mayor parte de Gram-negativas el peptidoglucano corresponde a la
composición y estructura que acabamos de describir. Sin embargo, en las
espiroquetas, el diaminoácido en posición 3, en vez de ser meso-DAP, está
sustituido por la L-ornitina (que también es un diaminoácido).
El enlace entre cadenas polisacarídicas se realiza normalmente mediante unión
peptídica directa entre el grupo carboxilo de la D-ala terminal y el grupo e-amino
del meso-DAP. Ahora bien, en este enlace
participan solamente el 50% de los tetrapéptidos. Los demás péptidos no
participan en enlaces, y entre estos últimos se encuentran incluso dipéptidos
y tripéptidos.
El resultado es una capa
simple de PG (de 1 nm de espesor), a modo de malla floja, y con
grandes poros (los “huecos” dejados por las zonas donde no hay enlace peptídicos).
Ello explica el comportamiento de las bacterias Gram-negativas en la tinción de
Gram: al añadir el alcohol, se produce una deshidratación que tiende a
contraer la estructura del PG, pero los poros son grandes y por ellos sale el
primer colorante (el violeta de genciana). El ulterior tratamiento de la
preparación con el colorante de contraste (fuchsina o safranina) tiñe a estas
bacterias de rojo.
Es más variado que el de Gram-negativas, sobre todo en función de
ciertas variantes en la composición del
tetrapéptido y del tipo de enlaces
entre los tetrapéptidos.
 |
Variantes
en composición del tetrapéptido:
 |
En
bacterias Corineformes:
 |
el
grupo -CO- en a
del D-glu (2) puede estar amidado o unido a una glicina (Gly); |
 |
el
aa (1) puede ser Gly o L-Ser, en lugar de la L-ala; |
 |
el
hidroxilo en 6 del NAM puede estar acetilado, lo que hace que el PG
de estas bacterias sea resistente a la lisozima. |
|
 |
Muchas
bacterias Gram-positivas carecen de meso-DAP (3), y en su
lugar puede existir:
 |
LL-DAP |
 |
L-diaminobutírico (DAB) |
 |
L-lisina |
 |
L-homoserina |
 |
L-ornitina |
|
|
 |
Modalidades
de uniones interpeptídicas:
 |
enlace directo entre la D-ala(4) y el
-NH2 libre del diaminoácido en (3) |
 |
enlace D-ala(4)--X--diaminoácido(3),
donde X representa un puente, que puede consistir en:
 |
un solo aminoácido:
L-ala, o D-iso-Asn |
 |
un péptido corto:
 |
{L-ala--L-ala} |
 |
{L-ala}3 |
 |
{L-ala}3 --
L-ornitina |
 |
{Gly}5 |
|
 |
enlace
D-ala(4) ---{mismo
tetrapéptido}--- diaminoácido (3) |
 |
enlace entre D-ala(4) y el
D-glu(2) (y no el aa en 3), por medio de un péptido en el que debe
de existir obligatoriamente un diaminoácido (p. ej., D-lys,
D-ornitina). |
|
|
Desde el punto de vista estructural, el PG de Gram-positivas se
caracteriza por la existencia de múltiples capas, existiendo entrecruzamientos
tanto entre cadenas adyacentes en el mismo nivel como entre niveles distintos.
El resultado es una red
tridimensional gruesa (hasta 50 capas en algunos Bacillus),
y más compacta que en Gram-negativas. De todas formas, el grado de compacidad
varía entre especies, y depende de:
 |
nº
de NAM que contengan tetrapétidos que participen en entrecruzamientos; |
 |
longitud
del puente peptídico |
Ello condiciona a su vez la intensidad
de la gram-positividad en la tinción de Gram.
La arquitectura molecular del sáculo de mureína está aún sujeta a
debate. Sin embargo, uno de los modelos recientes más aceptado se podría
resumir de la siguiente manera:
 |
Los resultados de difracción de
rayos X parecen indicar que las unidades disacarídicas de las cadenas están
giradas unas respecto de otras, formando una estructura helicoidal de orden
4 o 5. A resultas de ello, los péptidos protruyen alternativamente: hacia
arriba, a la izquierda, hacia abajo, a la derecha, y vuelta a empezar, etc.
Esta organización permite que una cadena de PG se pueda unir con cadenas
cercanas de su mismo nivel, así como con cadenas por encima y por debajo de
su nivel, formando un perfecto entramado tridimensional (al menos en las
Gram-positivas). |
 |
La orientación de las cadenas
azucaradas en relación con la superficie celular aún está debatida.
Parece que se disponen casi paralelas a la superficie celular, con una
tendencia a una forma espiral por encima de la membrana citoplásmica. Si
consideramos una bacteria de forma bacilar, esta espiral cerrada se dispone
siguiendo el perímetro circular (y no siguiendo el eje longitudinal). Los
grupos tetrapeptídicos salen perpendicularmente de los NAM, en sentido
vertical hacia la membrana. Sin embargo, cuando dos tetrapétidos de un
nivel se unen entre sí, forman un puente casi horizontal, formando ángulos
de unos 90o repecto de los esqueletos carbonados, y siguiendo el
eje longitudinal de la célula. |
Esta estructura confiere una serie de
importantes propiedades:
1)
Gran
rigidez, que contrarresta las fuerzas osmóticas
a que está sometido el protoplasto (aguanta presiones de unas 5 a 15 atmósferas).
Esta rigidez depende de:
a)
el grado de
entrecruzamiento;
b)
el hecho de que el enlace
ß(1à
4) es muy compacto. La alternancia
regular entre anillos piranósicos de NAG y de NAM genera uno de los polisacáridos más estables
desde el punto de vista termodinámico, que recuerda en su “estilo” a la
quitina y a la celulosa;
c)
la alternancia en el tetrapéptido, de aminoácidos en configuraciones D y L supone una factor
adicional que confiere aún más fuerza estructural, y además permite que todas
las cadenas laterales de estos aminoácidos se dispongan hacia el mismo lado,
facilitando la formación de puentes de H.
2)
Pero, al mismo tiempo, la estructura permite una notable
flexibilidad. Ello colabora, junto con su rigidez, a soportar
variaciones amplias de la tensión osmótica del protoplasto.
3)
Condiciona
la forma celular. Aunque la química del
PG, por sí misma, no determina la forma, es su disposición espacial la
responsable principal de esta forma.
Como ya dijimos, el PG de las bacterias Gram-positivas se encuentra
inmerso en una matriz, que puede representar hasta el 50% del peso de la pared
celular, y que está constituida por largos polímeros denominados ácidos teicoicos, pudiendo existir
también (o en su lugar) los ácidos
teicurónicos y los lipoteicoicos.
Estos componentes llegan a sobresalir de la superficie celular y suministran
especificidad antigénica.
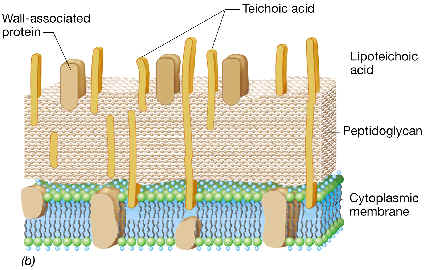
Ácidos teicoicos:
Están presentes en muchas bacterias Gram-positivas, pero no en todas.
Son polímeros de hasta 30 unidades de glicerol-fosfato o ribitol-fosfato,
unidas entre sí por enlaces fosfodiéster, en los que la mayoría de los grupos
-OH están sustituidos por -H, azúcares, aminoazúcares o D-alanina.
Los ácidos teicoicos están unidos covalentemente al peptidoglucano,
concretamente al -OH en posición 6 del NAM, a través de una unidad de enlace,
variable según las especies. (Por ejemplo, en una especie de Micrococcus, el elemento de enlace consiste en {glicerol-P}3
--NAG-P).
Ácidos teicurónicos:
Ciertas bacterias Gram-positivas, cuando se someten a un régimen de
limitación de fosfato son incapaces de sintetizar ácidos teicoicos, pero en su
lugar producen ácidos teicurónicos. Los teicurónicos consisten en polímeros
aniónicos formados por la alternancia de ácidos urónicos (que tienen grupos
-COOH libres) y aminozúcares como la N-acetil-galactosamina.
Ácidos lipoteicoicos:
Están presentes en todas las bacterias Gram-positivas, aun en
condiciones de carencia de fosfato. Se trata simplemente de ácidos
glicerol-teicoicos que se encuentran
unidos a la membrana citoplásmica, concretamente se unen por enlace
fosfodiéster con glucolípidos de membrana, mientras que el otro extremo de la
cadena queda expuesto al exterior.
En Streptococcus pyogenes las
cadenas de lipoteicoicos se encuentran asociadas con la llamada proteína M, originando una microfibrillas que sobresalen
notablemente hacia el exterior celular (observables a microscopio electrónico),
y que facilitan la unión a las células de animales en que parasitan estas
bacterias.
Funciones
de los polímeros de la matriz:
 |
Parece ser que su papel principal
es suministrar una carga neta negativa a la pared celular, lo que permite
captar cationes divalentes (p. ej., Mg++), que a su vez se
necesitan para muchas actividades enzimáticas de la membrana citoplásmica
o del espacio periplásmico, que participan de la morfogénesis y división
de la pared celular. |
 |
Como ya dijimos, los ácidos
teicoicos y teicurónicos son buenos antígenos. Cuando no están cubiertos
por estructuras más externas (como cápsulas), constituyen el antígeno somático O de las bacterias Gram-positivas. |
 |
Finalmente, en algunas bacterias,
sumistran, junto con el PG, receptores específicos para la adsorción de
ciertos bacteriófagos. |
Determinadas bacterias Gram-positivas (corineformes, Nocardia
y, en especial Mycobacterium)
presentan una pared celular muy compleja, con abundancia de lípidos (algo excepcional entre las
Gram-positivas).
Estas bacterias no se tiñen con los colorantes normales, pero una vez
que se han teñido con fucsina (forzando mediante calentamiento de la preparación),
tienen resistencia a decolorarse por una mezcla de ácido clorhídrico al 3% en
etanol de 96o. Por ello se denominan como bacterias ácido-alcohol resistentes. Esta
propiedad depende esencialmente de la presencia, en su pared celular de unos lípidos
llamados ácidos micólicos.
Químicamente, esta pared celular consiste en un esqueleto formado por
dos tipos de polímeros, unidos covalentemente entre sí:
 |
un peptidoglucano especial (la
diferencia más importante es que en vez de N-acetil murámico existe
N-glucolil-murámico); |
 |
un arabinogalactano de gran peso
molecular. |
 |
Ambos
polímeros se encuentran enlazados a través de fosfodiéster entre una
unidad de murámico y una de las arabinosas. Pero a su vez, este esqueleto
se une covalentemente a los ácidos
micólicos. |
Los ácidos micólicos son ß-hidroxiácidos grasos ramificados en a
, cuya longitud de cadena es grande (desde C78 a C91 en Mycobacterium).
Están unidos al esqueleto de la P.C. de forma uniforme, a través de enlaces
con los -OH en 5 de las unidades de arabinosa.
Por lo tanto, el esqueleto de la P.C.
de estas bacterias consiste en:
peptidoglucano---arabinogalactano---ácidos
micólicos.
Pero aparte de este esqueleto
complejo, la P.C. de las bacterias ácido-alcohol resistentes exhibe una
variedad de lípidos:
1)
Glucolípidos:
a)
Micolatos
de trehalosa:
dos unidades de trehalosa unidas entre sí por enlace a
(1à1´),
y en donde los grupos 6 y 6´ están unidos con ácidos micólicos. Constituyen
el llamado factor de crecimiento en
cuerdas, debido a que son responsables de la agregación de los individuos
bacterianos en forma de “cuerdas”.
b)
Sulfolípidos
de trehalosa: están localizados en la
periferia de la P.C., y parecen ser impartantes factores
de virulencia. En Mycobacterium
tuberculosis (el bacilo de la tuberculosis) estos sulfolípidos de trehalosa
funcionan como evasinas, es decir,
facilitan el que la bacteria escape a la acción de los macrófagos inhibiendo
la fusión del fagosoma con el lisosoma, lo cual puede explicar el hecho de que
estosmicroorganismos tengan éxito como parásitos intracelulares.
c)
Micósidos:
Localizados en la periferia, consisten en la unión por enlace éster entre ácidos
micólicos y azúcares (incluyendo ácidos urónicos, desoxiosas, aminozúcares,
etc.).
2)
Ceras:
Unión de ácidos micólicos con ftioceroles (alcoholes ramificados de alto peso
molecular: C30 - C34).
El alto contenido en lípidos confiere
una serie de propiedades a estas bacterias (aparte
de la ácido-alcohol resistencia ya citada):
 |
aspecto
y consistencia cérea de sus colonias; |
 |
crecen
formando grumos en medios líquidos; |
 |
gran impermeabilidad de la P.C.,
que a su vez condiciona una gran resistencia a la desecación y gran
resistencia a sustancias antibacterianas (detergentes, oxidantes, ácidos,
bases, etc). |
La pared de las bacterias Gram-negativas es estructuralmente más
compleja que la de Gram-positivas, cosa que se puede comprobar al observar un
corte transversal al microscopio electrónico: por
encima de la membrana citoplásmica y hasta el exterior se pueden apreciar 5
capas, alternándose las claras (L2, L5) y las oscuras (más
densas a los electrones: L1, L3, L4).
La capa densa L4 corresponde al peptidoglucano (ya estudiado),
que se encuentra inmerso en la capa clara L5, que consiste en un espacio
periplásmico, limitado entre la membrana citoplásmica y una membrana
externa. La delgada capa de peptidoglucano no constituye más del
5-10% de la pared. A continuación estudiaremos la peculiar membrana externa de
las bacterias Gram-negativas y el espacio periplásmico.
Se trata de una estructura de bicapa lipídica exclusiva de las bacterias
Gram-negativas. Como otras bicapas lipídicas, consta de una doble capa de lípidos,
junto con proteínas de matriz (estas últimas atravesando total o parcialmente
la bicapa). Por supuesto, en la bicapa lipídica, los grupos polares quedan
hacia afuera, mientras que los hidrófobos tienden al interior.
Ahora bien, la composición química y la disposición de los elementos
de esta membrana externa son muy distintos a los de una membrana típica:
 |
la
bicapa es altamente asimétrica: |
 |
en
la capa externa existe un 60% de proteínas y un 40% de una macromolécula
exclusiva de esta membrana externa: el lipopolisacárido
(LPS); |
 |
en
la capa interna no hay LPS, existiendo fosfolípidos (FL), lipoproteínas
(LPP) y otras proteínas. |
El conjunto es un mosaico fluido que
permite el desplazamiento lateral de los fosfolípidos, del LPS, y de las proteínas,
pero no de las lipoproteínas unidas covalentemente al peptidoglucano. Sin
embargo, esta fluidez
es menor que la de la membrana citoplásmica.
La membrana externa se encuentra unida con el peptidoglucano subyacente a
través de distintos componentes y tipos de enlaces:
 |
enlaces
iónicos, mediados por cationes divalentes, entre distintas proteínas
de la membrana externa y el PG; |
 |
enlaces
hidrófobos entre fosfolípidos y proteínas de la capa interior de
la membrana externa con el PG; |
 |
enlaces covalentes entre algunas moléculas de lipoproteína y el PG. |
Parece ser que la membrana externa está
en contacto directo con la plasmática en numerosos puntos, denominados zonas de
adhesión. Puede que se trate de regiones en las que produzca una auténtica
fusión entre estos dos tipos de membrana, facilitando quizá el transporte de
ciertas sustancias desde el exterior al interior celular.
Estudiaremos a continuación los
componentes de la membrana externa, aludiendo a su composición química,
estructura y funciones.
Se localizan en la lámina interna de la m. ext. La composición en
fosfolípidos es similar a la de la membrana citoplásmica, con un ligero
enriquecimiento en fosfatidil-etanolamina.
Se trata de una macromolécula exclusiva de la lámina externa de la
membrana externa de bacterias Gram-negativas, responsable de muchas de las
propiedades biológicas de estas bacterias. Se le conoce también con el nombre
de endotoxina
(toxina termoestable, no difusible). Se trata de un glucolípido complejo, que
podemos considerar compuesto de tres regiones o dominios:
 |
lípido
A, que es la porción más proximal,
y de carácter hidrofóbico; |
 |
región
intermedia, llamada oligosacárido
medular; |
 |
región distal (cadena lateral específica, polisacarídica)
a base de repeticiones de unos pocos azúcares. Es de carácter hidrofílico
y constituye el antígeno
somático O de las 6bacterias Gram-negativas. |
i)
El lípido A: esta región es prácticamente
idéntica en todas las bacterias Gram-negativas. Consiste en un disacárido
formado por dos unidades de glucosamina unidas por enlace ß(1à6),
pero donde todos los grupos -OH (menos uno) y -NH2 están sustituidos
(unidos a otras moléculas): Obsérvese que
 |
existen 5 (a veces 6) ácidos
grasos, todos ellos saturados, con predominio de ß-hidroximirístico (un ácido
graso C14). |
 |
El
-OH original en 4´ está sustituido por arabinosamina-fosfato. |
 |
El
-OH en 1 está sustituido por fosforil-etanolamina (a veces
pirofosforil-etanolamina). |
ii)
El oligosacárido medular
(también llamado corazón o núcleo):
se une al lípido A a través del -OH en 3´. Se pueden considerar dos
fracciones:
 |
la fracción del núcleo interno,
a base de dos tipos de azúcares exclusivos de Gram-negativas:
2-ceto-3-desoxioctónico (KDO) y L-glicero-D-manoheptosa (Hep). Alguna de
las Hep y alguno de los KDO pueden a su vez estar unidos a
fosforil-etanolamina (o pirofosforil-etanolamina). Esta región es muy rica en grupos cargados, especialmente con carga negativa (de los
fosfatos y KDO). |
 |
La
fracción del núcleo externo está constituida a base de hexosas (glucosa,
galactosa, NAG, y a veces algunas hexosas más raras). |
iii)
Cadena lateral específica:
polisacárido repetitivo, que se proyecta hacia el exterior celular, y
que constituye el Ag
somático O de bacterias Gram-negativas. Consiste en la repetición
(hasta 40 veces) de unidades
tri-, tetra- o pentasacarídicas (en estos dos últimos casos uno de
los azúcares de cada repetición queda lateral respecto del esqueleto lineal
que forman los demás).
De todas estas regiones del LPS la única indispensable
para la viabilidad es el lípido A. Los mutantes incapaces de sintetizar las
cadenas laterales o el oligosacárido medular dan colonias rugosas y están
afectados en distintas propiedades biológicas, pero pueden sobrevivir.

PAPELES Y
FUNCIONES DEL LPS
1.
Papel
estructural: el LPS es el componente
esencial de la membrana externa. La porción hidrofóbica (las cadenas de ácidos
grasos del lípido A) se proyectan hacia el interior de esta membrana.
Precisamente es la estructura del lípido A la principal responsable de la menor
fluidez de dicha membrana, y por lo tanto de la mayor resistencia física. (Obsérvese
que, mientras cualquier fosfolípido tiene dos cadenas de ácido graso, el lípido
A posee 5 o 6, todas ellas unidas al mismo disacárido, generando una molécula
más “masiva.”).
2.
A su vez, la propiedad anterior hace que sea menos soluble a detergentes y más resistente a disolventes orgánicos.
3.
Es menos
permeable a muchas moléculas hidrofóbicas, incluyendo antibióticos,
debido a las largas cadenas laterales hidrofílicas.
4.
Se une a cationes divalentes (como Mg++ o Zn++), lo
que contribuye a la mayor estabilidad de la membrana externa. Esta presencia de
cationes suministra un ambiente
adecuado para muchas funciones de la P.C. (Si añadimos un agente quelante como el EDTA, o eliminamos el Mg++
y lo sustituimos por Ca++, se produce la desorganización de la
membrana externa).
5.
Como ya dijimos, el LPS constituye la endotoxina de las bacterias Gram-negativas. La función como
endotoxina se debe a la región del lípido A. Sus propiedades como endotoxina
están en el origen de muchos síntomas patológicos propiciados por patógenos
Gram-negativos:
a.
pirogenicidad (inducción de fiebre)
b.
hipotensión
c.
en casos graves, choque letal, por fallo cardíaco
d.
actividad necrótica de tejidos.
6.
Pero igualmente, tiene efectos beneficiosos:
estimula una serie de mecanismos defensivos del hospedador, incluyendo la
activación del complemento, que puede ocasionar la lisis de la bacteria, mejora
las propiedades de los fagocitos, etc. Es decir, a pesar del nombre de
endotoxina, el LPS no es intrínsecamente tóxico, sino que su efecto depende de
la respuesta del hospedador. El macrófago es la célula del hospedador
principal responsable de la mediación de los efectos del LPS, tanto los
positivos como los negativos. El macrófago posee receptores de membrana para
detectar el LPS bacteriano, y en respuesta a él, libera una serie de moléculas
mediadoras (citoquinas) que actúan a su vez sobre diversas partes del sistema
inmunitario. De hecho, los efectos negativos se deben a comportamientos
incontrolados desencadenados en el propio sistema inmunitario.
7.
El LPS, y concretamente las cadenas laterales constituyen el antígeno
somático O, cuya especificidad viene determinada por la secuencia
repetitiva de azúcares. Esta porción condiciona la virulencia
de las bacterias Gram-negativas patógenas, por lo que debe de ser esencial en
la interacción hospedador-parásito.
2.5.1.1.3
La
lipoproteína (LPP, lipoproteína de Braun)
Su porción polipeptídica es una pequeña proteína (7.2 kDa) muy
abundante en la membrana externa, y es la responsable de la unión covalente
entre ésta y el peptidoglucano. La proteína tiene una configuración
mayoritaria en a-hélice,
que atraviesa el espacio periplásmico, y parece que se agrega formando trímeros.
Una de las LPP del trímero (por término medio) se une covalentemente con el
peptidoglucano.
El aminoácido N-terminal es una cisteína cuyo grupo sulfhidrilo está
unido por enlace tioéter a un diglicérido, y cuyo grupo amino se une por
enlace amido con un ácido graso (p. ej., palmítico). De este modo, la porción
N-terminal de la LPP está
embebida en la lámina interna de la membrana externa.
El aminoácido C-terminal es una lisina. Una de cada tres moléculas de
LPP usa esta Lys para establecer un enlace peptídico entre su propio grupo -NH2
libre y el -COOH libre del meso-DAP del PG. Por término medio, por cada diez
unidades disacarídicas del PG, existe un enlace covalente con la LPP.
La principal (y probablemente única) función de la lipopproteína es
meramente estructural: estabilizar el complejo entre peptidoglucano y membrana
externa. Esta unión es tan fuerte que permite aislar la membrana externa y el
peptidoglucano como una unidad.
2.5.1.1.4
Proteínas
de la membrana externa
Están intercaladas en esta membrana, participando en la estabilización
de la arquitectura tridimensional, interaccionando unas con otras y con los lípidos.
Entre ellas, las más importantes son las porinas.
Las porinas
son proteínas de unos 35 kDa, que se agregan formando trímeros
con canales interiores, y que atraviesan la membrana de parte a parte. Su función
es permitir el paso de sustancias a través de dichos canales interiores,
siempre que su peso molecular sea compatible con el tamaño de los canales
(suelen ser moléculas entre 500 y 700 dalton). En las enterobacterias, las
porinas colaboran en la protección
contra las sales biliares que existen en el ecosistema intestinal donde pasan
parte de su vida.
Existen otras proteínas minoritarias parecidas a porinas, que actúan
como canales específicos
que permiten el paso de ciertas moléculas: vitamina B12,
quelatos de Fe, nucleósidos, maltodextrinas, etc. Algunas de ellas sirven
simultáneamente como receptores de fagos.
1)
Actúa como tamiz molecular, que permite la difusión
únicamente de moléculas relativamente pequeñas. Esto supone una protección
frente a muchos agentes antibacterianos: colorantes, ácidos
biliares, antibióticos, enzimas (p. ej., la lisozima, que podría alcanzar y
atacar al PG). Recuérdese que las porinas sólo permiten el paso de sustancias
hidrofílicas por debajo del tamaño especificado por el diámetro de los
canales.
2)
Condiciona propiedades de superficie:
a)
grado de humedad (humectabilidad)
b)
adhesividad
c)
carga eléctrica.
3)
Es la estructura donde
se fijan los componentes del complemento (sistema defensivo de los
animales superiores que conduce a la inserción, en la membrana externa, de una
serie de proteínas llamadas complejo de ataque a la membrana, que agujerea
dicha membrana y ocasiona la lisis de la bacteria).
4)
Ciertas proteínas y cadenas laterales del LPS pueden ser lugares de
adsorción (receptores específicos) de fagos y bacteriocinas.
5)
Punto de anclaje del anillo externo (“L”) del corpúsculo basal de
los flagelos.
2.5.2
EL ESPACIO PERIPLÁSMICO
Entre la membrana externa y la membrana citoplásmica existe un
compartimento acuoso bañando al peptidoglucano, denominado periplasma
o espacio periplásmico. El volumen de este compartimento puede
llegar a representar un 20-40% del volumen celular total. El contenido del
periplasma (el “gel periplásmico”) incluye:
 |
RNasa y fosfatasa, que digieren
moléculas que por sí mismas no pueden pasar al citoplasma. |
 |
Penicilinasa: degrada penicilina,
evitando destrucción de PG |
 |
proteínas
de transporte de nutrientes (p. ej., de maltosa) |
 |
proteínas
de transporte de nutrientes (p. ej., de maltosa) |
 |
proteínas de unión a estímulos
químicos. |
 |
En
bacterias desnitrificantes y quimiolitoautotrofas, existen proteínas
implicadas en el transporte de electrones. |
El periplasma cumple una función
de osmorregulación: El periplasma es una solución densa, con alta
concentración de macromoléculas, y que participa en la regulación de la
osmolaridad celular frente a la tonicidad del medio exterior. Para ello, existe
en este espacio periplásmico un oligosacárido
derivado de la membrana citoplásmica (ODM, o según sus iniciales
inglesas, MDO), a base de 10 unidades de ß-D-glucosa (unidas entre sí por
enlaces 1à2)
con sustituyentes ácidos.
 |
En
medios de alta osmolaridad (por ejemplo, en los fluidos corporales),
disminuye la concentración del oligosacárido. |
 |
En
ambientes de baja osmolaridad (p. ej., aguas fecales), aumenta mucho la
concentración de dicha molécula. De este modo, la presión de turgor del
protoplasto se transmite contra el peptidoglucano, que como sabemos ya, es
la estructura de la pared celular. que aguanta las variaciones de presión
osmótica. |
Aunque las arqueas pueden comportarse como Gram-positivas o como
Gram-negativas, no se suele aludir a esto en este dominio de procariotas, ya que
sus paredes tienen poco que ver con las de eubacterias. Exceptuando el género Thermoplasma, carente de pared celular, las demás arqueas poseen,
por encima de la membrana citoplásmica, algún tipo de estructura con funciones
de pared celular.
 |
En muchos casos las funciones de
pared celular son ejercidas simplemente por una capa S paracristalina (véase
tema 4), a base de disposición regular de subunidades idénticas de una
proteína o glucoproteína (p. ej., Methanococcus,
Methanogenium). Recuerde que en ciertas arqueas de ambientes extremos,
esta capa S está estabilizada por factores de esos ambientes: En el halófilo
obligado Halobacterium las
subunidades de glucoproteína se estabilizan por altas concentraciones de ión
Na+. En el termoacidófilo Sulfolobus
la estabilidad la confieren los bajísimos pH. |
 |
En Methanospirillum y en Methanothrix
varias células, cada una con su capa S, se encuentran englobadas por una
vaina común, a base de proteínas y carbohidratos, con una estructura a
base de anillos paralelos. |
 |
En Methanosarcina y Halococcus la capa S se encuentra rodeada de
metanocondroitina, un polímero a
base de N-acetil-galactosamina, glucurónico, glucosa y manosa. (Esta
metanocondroitina es similar al condroitín sulfato presente en tejido
conjuntivo de animales). |
 |
Finalmente, los miembros del orden
Methanobacteriales poseen una
pared de pseudomureína, un extraño
peptidoglucano no basado en NAM. Consiste en un esqueleto de unidades
repetitivas de NAG unidas por enlace ß(1à3)
con N-acetil-talosaminourónico (NAT, un azúcar exclusivo de estos
organismos). El grupo -NH2 del NAT va unido a su vez con un
tetrapéptido, pero en éste sólo participan aminoácidos de la serie L. Al
igual que en la mureína de las eubacterias, las diversas cadenas se unen
entre sí por enlaces peptídicos entre el aminoácido terminal (4) de un
tetrapéptido y el diaminoácido (3) de otra cadena.

|
ARTÍCULOS
DE DIVULGACIÓN
CASTILLO, F. y otros (2003): El
periplasma procariota. Investigación y Ciencia 321 (junio): 74- 82.
FISCHETTI, V.E. (1991): Proteína
estreptocócica M. Inv. y Ciencia 179
(agosto):
RIETSCHEL, E.T., H. BRADE (1992):
Endotoxinas bacterianas. Inv. y Ciencia 193:
16-24.
ARTÍCULOS
DE REVISIÓN
FERGUSON,
S.J. (1992): The periplasm. en “Prokaryotic structure and function: a new
perspective”. Society for General Microbiology & Cambridge University
Press, pp.311-339.
HANCOCK,
R.E.W. (1991): Bacterial outer membranes: evolving concepts.
ASM news 57: 175-182.
HANCOCH,
R.E.W., R. SIEHNEL, N. MARTIN (1990): Outer membrane proteins of Pseudomonas.
Molec. Microbiol. 4: 1069-1075.
NIKAIDO,
H. (1996): Outer membrane. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C. (1996), págs. 7-22.
OLIVER, D.B. (1996):
Periplasm. En:
“Escherichia coli and Salmonella
typhimurium. Cellular and molecular biology”, 2ª edición (F.C. Neidhart,
ed.). American Society for Microbiology Press. Washington, D.C. (1996), págs. 88-103.
PARK,
J.T. (1996): The murein sacculus. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C. (1996), págs. 48-57.
RAETZ,
C.R.H. (1990): Biochemistry of endotoxins.
Annu. Rev. Biochem. 59:
129-170.
SCHIRMER,
T., J.P. ROSENBUSCH (1991): Prokaryotic and eukaryotic porins.
Curr. Opin. Struct. Biol. 1:
539-545.

[ Introducción e Historia ] [ Rasgos generales procariotas ] [ Tamaño y forma ] [ Estructuras superficiales ] [ Paredes procariotas ] [ Síntesis peptidoglucano ] [ Membrana y transporte ] [ Citoplasma y su contenido ] [ Apéndices filamentosos procariotas ] [ Diferenciaciones celulares ] [ Captación de energía ] [ Nutrición microbiana ] [ Ciclo celular y crecimiento ] [ Agentes físicos ] [ Agentes químicos ] [ Regulación génica ] [ Mutaciones en procariotas ] [ Recombinación. Transformación ] [ Conjugación ] [ Transducción ]

Secciones de esta web:




Actualizada el jueves, 16 de octubre de 2003

![]()










