

Actualizado el miércoles, 15 febrero 2006
1.1 INTRODUCCIÓN: LA MOVILIDAD EN LAS BACTERIAS
1.3 COMPOSICIÓN QUÍMICA Y ESTRUCTURA
1.5.1 DESCRIPCION DEL MOVIMIENTO DE UNA BACTERIA PERITRICA
1.5.2 MECANISMO DEL MOVIMIENTO ALEATORIO (EN AUSENCIA DE ESTÍMULO)
1.5.2.1 EL MOTOR ES ROTATORIO Y GIRA EN AMBOS SENTIDOS
1.5.3.3 ESTUDIO DE LA QUIMIOTAXIA Y DE LA ADAPTACIÓN
1.5.3.3.1 ESTÍMULOS DEL SISTEMA DE RECEPCIÓN, TRANSDUCCIÓN DE SEÑAL Y ADAPTACIÓN
![]()
Los procariotas capaces de moverse lo hacen por alguno de estos sistemas:
|
Por flagelos provistos de un motor rotatorio | |||||
|
Por pelos de tipo IV, que dan lugar a dos tipos de desplazamiento:
| |||||
|
Por secreción de sustancias mucosas a través de “toberas” (conjuntos de poros especiales) en la superficie celular: lo que da origen a deslizamiento en ciertas cianobacterias y en mixobacterias, a modo de “patinaje” de la célula sobre el moco depositado sobre la superficie. | |||||
|
Por un mecanismo de trinquete, responsable del deslizamiento en especies del grupo Cytophaga-Flavobacterium. En este caso existen un doble juego de proteínas, uno de membrana citoplásmica y otro de membrana externa. Ambos juegos están engarzados entre sí probablemente a nivel del peptidoglucano. Las proteínas de membrana citoplásmica se desplazan, y a su vez provocan movimiento en las de membrana externa. Todo ello se asemeja a una “correa sin fin” o cadena de un tanque, que al moverse en un sentido sobre una superficie, impulsan a la célula en el sentido opuesto. |
El mejor estudiado de todos esos sistemas es de los flagelos. Los flagelos eubacterianos típicos son largos apéndices filamentosos extracelulares, helicoidales, responsables del desplazamiento en medios líquidos de la mayor parte de las bacterias móviles. Aunque empleamos la misma palabra para designar a los orgánulos locomotores de procariotas y eucariotas, ambos son totalmente diferentes, tanto en estructura como en mecanismo de funcionamiento:
|
El filamento del flagelo bacteriano, que constituye su porción externa más visible, consta generalmente de un solo tipo de proteína, y en él no se realiza ningún trabajo quimiomecánico. | |
|
El mecanismo del flagelo bacteriano es rotatorio, con un motor reversible (funciona en los dos sentidos de giro). | |
|
La energía que propulsa a este motor no es ATP ni ninguna otra molécula con enlaces energéticos, sino que deriva directamente del gradiente de protones (fuerza protón-motriz). |
|
En preparaciones en fresco a microscopía óptica normal no se pueden detectar los flagelos individuales, debido a su extrema delgadez (están ligeramente por debajo del límite resolutivo del microscopio). El microscopio de contraste de fases logra visualizar los penachos densos de flagelos de ciertas bacterias. | |
|
En cambio, la microscopía óptica de alta intensidad en campo oscuro, así como la microscopía fluorescente sí logra discernir los flagelos. | |
|
Pueden estudiarse fácilmente mediante impregnación argéntica en preparaciones previamente fijadas por procedimientos suaves que no destruyan la estructura (alcohol-éter) y con mordientes que la engruesan artificialmente: ácido tánico, sales de Al y Cr. (remitimos al alumno a la correspondiente práctica). |
Los flagelos se observan como filamentos helicoidales largos y finos. La longitud es variable (no está determinada de modo fijo): de 5 a 10 mm, pero su anchura o diámetro es constante y uniforme para cada especie: en Escherichia coli es de 20 nm. El carácter helicoidal del filamento es propio e intrínseco: para cada especie los parámetros de la hélice (longitud de onda y amplitud) son fijos y característicos.
Existe una serie de especies Gram-negativas (Vibrio, Photobacterium, Bdellovibrio) que poseen flagelos muy engrosados, debido a que están envueltos en una vaina que presenta continuidad con la membrana externa.
El patrón de flagelación (es decir, el número y localización de los flagelos) varía entre especies, y reviste interés en la determinación taxonómica:
|
un solo flagelo: bacterias monotricas. Normalmente la inserción del flagelo (en bacterias bacilares) es polar o subpolar. | |
|
dos o más flagelos formando un penacho, normalmente en un polo: lofotricas. (por ejemplo, en Spirillum volutans hay más de 80 flagelos en el penacho). | |
|
dos penachos de flagelos, uno en cada polo: bacterias anfitricas. | |
|
flagelos repartidos por toda la superficie: bacterias peritricas. (Por ejemplo, Escherichia coli posee 10 flagelos, mientras que Proteus mirabilis posee cientos, dando aspecto muy denso a la disposiciòn de éstos). | |
|
Ciertas bacterias presentan flagelos de inserción lateral, bien en penachos densos (Selenomonas), bien diseminados (Pectinatus). |
Existe una serie de especies Gram-negativas (Vibrio, Photobacterium, Bdellovibrio) que poseen flagelos muy engrosados, debido a que están envueltos en una vaina que presenta continuidad con la membrana externa
El flagelo eubacteriano es una de las estructuras procarióticas más complejas, formada por más de 20 tipos de proteínas estructurales. Ya a microscopía electrónica se pueden distinguir tres partes o subestructuras:
|
filamento helicoidal largo; está conectado a un corto segmento curvado denominado... | |||||||
|
codo o gancho, que a su vez está unido al... | |||||||
|
corpúsculo basal. Este corpúsculo basal está inmerso en las envueltas (membrana citoplásmica y pared), y consta esencialmente de un cilindro que ensarta 1 o 2 parejas de anillos. En los últimos años se ha visto que, relacionado con este corpúsculo existen más subestructuras. En conjunto, este corpúsculo “ampliado” que ahora conocemos tiene varias funciones:
|
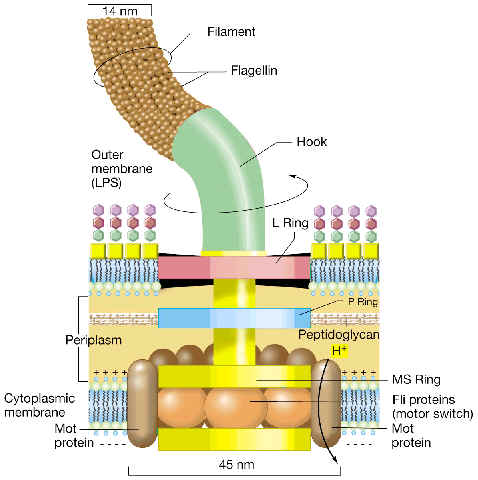 |
Estructura de un flagelo de una bacteria Gram-negativa |
El filamento es una estructura cilíndrica fina, hueca y rígida, con aspecto helicoidal. Está constituido por el arrollamiento de miles de subunidades idénticas de una proteína llamada flagelina. La flagelina es una proteína globular relativamente elongada, con pesos moleculares variados, según las especies (desde unos 15 kDa en algunos Bacillus hasta unos 62 kDa en algunas enterobacterias). Las subunidades de flagelina se disponen formando una matriz cilíndrica, en la que se distinguen 11 hileras cuasi-axiales (casi verticales) de subunidades; las hileras cuasi-axiales se denominan fibrillas. El cilindro está hueco (deja un canal en su interior de unos 3 nm). El filamento es notablemente rígido, de modo que durante el movimiento activo sólo se producen pequeñas deformaciones, pero sin afectar a los parámetros de la hélice.
En el extremo distal del filamento existe un “capuchón” formado por un pentámero de una proteína distinta (HAP2). Entre el filamento y el codo existen dos discos estrechos con dos tipos de proteínas (HAP3 y HAP1). Son estructuras adaptadoras que permiten la correcta interacción entre filamento y codo.
El filamento tiene un papel “pasivo”, actuando de manera análoga a la hélice de un barco. El movimiento de rotación del motor (situado, como veremos, en el corpúsculo basal) se comunica (a través del codo) al filamento helicoidal rígido, lo que permite el avance de la bacteria.
Tanto la flagelina nativa aislada como los filamentos intactos son buenos antígenos, constituyendo el denominado antígeno H flagelar, específico para cada especie e incluso para cada estirpe o raza.
Es una estructura curvada, acodada, de 55 nm de longitud, y 22 nm de diámetro, que conecta el filamento al corpúsculo basal. Consta de unas 120 unidades de una proteína elongada, distinta de la flagelina (42 kDa), dispuestas igualmente en una matriz cilíndrica de 11 fibrillas. Parece ser que el codo actúa a modo de juntura universal o flexible entre el filamento y el corpúsculo basal.
Entre el codo y el filamento existen dos discos de proteínas accesorias del codo (HAP1 y HAP3). Cada uno de los discos consiste en dos giros de hélice, e intervienen en el control del ensamblaje del flagelo. Son estructuras adaptadoras que permiten la correcta interacción entre filamento y codo.
Entendido el corpúsculo basal en su sentido actual (más amplio de lo que sabíamos hace unos años), es una notable estructura que, inmersa en la membrana citoplásmica y en la pared celular, posee varias funciones:
|
ancla el flagelo a la célula | |
|
está relacionada con la función del motor rotatorio y del conmutador (cambio del sentido de giro) | |
|
alberga el aparato para la secreción y correcto ensamblaje de la mayor parte del flagelo |
En Gram-negativas, consta de dos pares de anillos coaxiales atravesados por un cilindro central hueco, junto con otra serie de subestructuras anejas a todo lo anterior:
|
Los dos anillos exteriores se denominan L y P, y están relacionados respectivamente con la membrana externa y con el peptidoglucano. (A veces estos dos anillos están conectados por una pared cilíndrica que enmascara la porción del cilindro central). | |||||
|
Los dos anillos interiores se denominan S y M: el S está en el espacio periplásmico, inmediatamente por encima de la membrana citoplásmica, y el M está inmerso plenamente en dicha membrana. Como ambos anillos están muy juntos, a veces se alude a ellos como “anillo MS”. | |||||
|
Ya hacia el lado citoplásmico de la membrana, por debajo del anillo M (y en contacto con él) existe un quinto anillo, llamado anillo C, en el que existen tres proteínas. Una de ellas, (FliG) parece ser el elemento central del rotor, mientras que las tres (FliG, FliM y FliN) están implicadas en la conmutación del sentido del giro del motor: permiten que el motor pueda girar en sentido de las agujas del reloj y en el sentido contrario al de las agujas del reloj. | |||||
|
Rodeando al corpúsculo basal, a modo de empalizada cilíndrica, existen subunidades de dos proteínas integrales de membrana: MotA y MotB. Su papel parece ser doble:
| |||||
|
En el hueco interior formado por los anillos MS y C se aloja una serie de proteínas implicadas en la secreción de los monómeros de componentes del flagelo. |
Con todo ello, la hipótesis que se maneja hoy es que, con el “carburante” de protones, el rotor gira respecto del estator. Este giro se comunica al cilindro central, que a su vez debe de estar bien engarzado con al menos alguno de los otros cuatro anillos. El giro se transmite al codo y, de éste al filamento. Como el filamento es una hélice rígida, al girar hace avanzar a la bacteria en el medio acuoso.
En Gram-positivas la estructura del corpúsculo basal es más sencilla: cilindro central y una sola pareja de anillos (el M y el S). Probablemente el anillo S está conectado con el peptidoglucano (sería análogo en realidad al anillo P de las Gram-negativas).
En la “construcción” del flagelo bacteriano intervienen unas 50 proteínas, entre proteínas estructurales que formarán parte de la estructura definitiva (unas 20), y proteínas accesorias que sólo sirven durante este ensamblaje (unas 30). Debido a esta complejidad, y a que, además, diversas partes del flagelo deben de interaccionar con las envueltas bacterianas (membrana, pared), no es de extrañar que este ensamblaje esté bien ajustado ni que la síntesis de las diversas “piezas” esté sometida a un estricto control genético.
El orden de ensamblaje es en su mayor parte lineal y secuencial: tiene lugar desde las subestructuras más proximales hasta las más distales.
|
Los componentes integrales de membrana (excluyendo a las proteínas Mot), el doble anillo MS y el anillo C emplean la “habitual” ruta Sec (procesamiento de pre-proteínas con escisión del péptido líder). | |||
|
Pero la mayor parte de las proteínas cuyo destino está más allá de la membrana citoplásmica usan una ruta especial, que es una variante del denominado sistema III de exportación. Como dijimos, el aparato para esa exportación se alberga en el hueco de los anillos MS. Este aparato va exportando ordenadamente las subunidades de las distintas subestructuras, las cuales viajan “en fila india” a través del canal interior continuo (que a su vez se va construyendo) del cilindro à codo à filamento. Las subunidades se van añadiendo en el correspondiente extremo distal de la subestructura en formación, y evitan su escape al medio merced a unas proteínas de “capuchón” en dichos extremos distales.
|
En este apartado nos vamos a plantear dos objetivos de estudio principales:
|
descripción del movimiento por flagelos (apartados 1.5.1) | |
|
mecanismo del movimiento en ausencia de estímulos (1.5.2) | |
|
cómo se ve modificado el mecanismo flagelar básico ante la llegada de estímulos ambientales captados en la superficies celular (1.5.3). |
Vamos a estudiar en primer lugar cómo se produce el movimiento en bacterias peritricas como Escherichia coli o Salmonella tiphymurium.
1. En ausencia de estímulos, en un medio ambiente uniforme, se puede observar un movimiento tridimensional aleatorio, formado por periodos de unos pocos segundos de natación en linea recta o ligeramente curvada (carreras o corridas), interrumpidos por breves episodios (décimas de segundo) de un movimiento angular caótico de la bacteria (viraje o cabeceo), tras de lo cual la célula entra en una nueva fase de natación en línea aunque con una nueva dirección.
2. En un gradiente espacial de un estímulo ambiental, la bacteria responde modificando el anterior patrón. Se alteran las probabilidades relativas de carreras y de virajes, de modo que la bacteria prolonga estadísticamente los periodos de natación hacia la dirección favorable (es decir, acercándose hacia un estímulo positivo y alejándose de uno negativo), y disminuye la frecuencia de cabeceo. De esta manera se obtiene una locomoción aleatoria pero estadísticamente sesgada, que propicia el avance neto en la dirección favorable. Este movimiento se denomina taxia.
3. El comportamiento táxico dura un tiempo limitado, que oscila de segundos a minutos, dependiendo de la naturaleza e intensidad del gradiente. Tras la fase de excitación inicial y de taxia, la bacteria se va adaptando al estímulo, de modo que regresa finalmente al patrón aleatorio de movimiento, sin avance neto en ninguna dirección.
Así pues, en las próximas páginas veremos la base de estos fenómenos:
|
existencia de un rotor flagelar de tipo rotacional, que es reversible. | |
|
Veremos que la bacteria tiene mecanismos para detectar un gradiente espacial de un estímulo, y comprobaremos que este mecanismo actúa como si la bacteria estuviera detectando de hecho un gradiente temporal. | |
|
Conectado con el sistema de detección de estímulos, hay un sistema que hace que se vuelva al patrón aleatorio ante la persistencia del estímulo (mecanismo de adaptación). |
Vamos a resumir lo que veremos con más detalle a continuación:
|
El motor es rotatorio y tiene dos estados: giro en sentido antihorario, es decir contrario a las agujas del reloj (CAR), y sentido horario, igual al de las agujas del reloj (AR) | |
|
Componentes y funcionamiento del motor y del conmutador y su relación con la movilidad por carreras y con las volteretas | |
|
Aspectos energéticos del motor: el “carburante” del motor es la disipación de protones a través de cierta parte del corpúsculo basal. |
Desde hace varios años, por experimentos en los que las bacterias quedaban unidas a cubreobjetos por anclaje a ellos de los filamentos flagelares, se dedujo que el motor flagelar funciona como una máquina rotacional reversible, o sea, tiene dos sentidos: el de las agujas del reloj (AR) y el contrario (CAR).
Veamos a continuación las relaciones que se dan entre estos estados funcionales del motor y los fenómenos de rotación en línea y virajes bruscos.
|
La natación en línea (carrera) se debe a la rotación continua, durante un periodo de unos segundos, del motor, en sentido CAR. En las bacterias peritricas, las fuerzas hidrodinámicas y mecánicas hacen que los filamentos de los distintos flagelos se enrollen formando un haz o penacho paralelo al eje longitudinal de la célula. En este penacho, cada flagelo gira independientemente. El giro de los diversos filamentos helicoidales del penacho, empuja a la célula, originando la natación en linea recta, con una velocidad de unos 25 mm/seg. | |
|
Cuando el motor gira en sentido inverso, o sea AR, la nueva carga torsional que hace que el flagelo cambie de conformación. Mientras está cambiando esa conformación, cada filamento tira independientemente de un lado de la célula, lo que hace que esta pegue una voltereta que la reorienta de modo aleatorio. |
Como ya dijimos, parece que la empalizada de proteínas integrales Mot A y Mot B forman parte del estator del motor. Esta empalizada rodea al doble anillo MS, y probablemente sobre esta base fija gira el rotor (FliG) situado bajo el doble anillo MS. Por debajo de éste, el anillo C, con sus tres tipos de proteínas (FliG, M y N) actúa como conmutador del sentido de giro. El giro se transmite solidariamente al cilindro central, de él al codo, y de ahí al filamento helicoidal.
Si no existiera sistema de conmutación del sentido de giro, el motor giraría siempre en sentido antihorario o sea, el sentido intrínseco (“por defecto”) de rotación del motor flagelar es el CAR. Pero el motor recibe la influencia del sistema conmutador del anillo C, que de vez en cuando invierte el sentido de giro (AR). Como veremos luego, a su vez el sistema conmutador recibe información sensorial lo que se supondrá que se alteraren las proporciones de tiempo en que el motor gira en un sentido o en otro.
En condiciones normales con disponibilidad de nutrientes energéticos en el medio ambiente de la bacteria, la forma de energía que alimenta el motor flagelar es la fuerza protón motriz (f.p.m.), es decir, el potencial electroquímico de protones (y en las bacterias marinas y alcalófilas, la fuerza motriz de los iones Na+).
La hipótesis actual sobre la manera en que se acopla el flujo de protones al motor con la rotación dice lo siguiente: cuando los protones cruzan la membrana citoplásmica, se unen a un determinado aspártico de la proteína MotB, lo cual le provoca un cambio conformacional. Este cambio conformacional del estator hace que el motor realice un paso de rotación (una fracción de un giro). Luego, ese protón sale de la proteína MotB y entra al citoplasma, con lo que se regenera la configuración original del estator. Para que el motor haga un giro completo, se necesitan unos 1000 protones. A su vez, el motor gira a la “vertiginosa” velocidad de 1000 revoluciones por minuto. De todas formas, la velocidad de rotación es variable, y depende de la intensidad del gradiente de protones.
De ese modo, la bacteria nada a altas velocidades relativas, de hasta 100 mm/seg., (si un coche corriera a la misma velocidad relativa…¡rompería la barrera del sonido!).
En ausencia de un gradiente de estímulo, el movimiento de cada célula es a base de períodos de 2-4 segs de natación separados por virajes. El movimiento en un gradiente de estímulo se logra variando la frecuencia de virajes: si la concentración de un atrayente aumenta, o la de un repelente disminuye, las células no viran tan frecuentemente como lo harían en un entorno uniforme. Por lo tanto, el resultado es que nadan en la dirección favorable más tiempo, y este sesgo respecto de la natación aleatoria hace que exista un movimiento neto en relación con el gradiente.
Este mecanismo no es una taxia en sentido estricto (se le puede llama clinocinesis, aunque este término apenas se emplea); es un 50% menos efectivo que una taxia auténtica, pero probablemente requiere mucha menos inversión en maquinaria sensorial y motora.
Se distinguen principalmente aerotaxia, fototaxia y quimiotaxia.
1) aerotaxia: respuesta de migración ante un gradiente de oxígeno molecular.
|
Bacterias anaerobias àaerotaxia negativa. | |
|
Bacterias microaerófilas à atraídas a tensiones óptimas de O2 (menores que la atmosférica). | |
|
Todas las bacterias aerobias y anaerobias facultativas à aerotaxia positiva. |
La aerotaxia positiva, al menos en enterobacterias, y en bacterias purpúreas en crecimiento heterotrófico, tiene un mecanismo diferente del mecanismo táxico hacia otros atrayentes químicos: no existe en realidad un receptor específico del oxígeno. La señal estimulatoria consiste en la utilización del oxígeno como aceptor final de electrones en las cadenas transportadoras respiratorias. Esto provoca una alteración de la f.p.m., que de alguna manera provoca un cambio que aumenta la probabilidad de giro del rotor en sentido CAR.
2) Las fototaxias de las bacterias fotosintéticas anóxicas dependen de un mecanismo similar: detectan un gradiente de intensidad de luz, no mediante un receptor especial, sino por medio del transporte de ee- fotosintético, que a su vez provoca un cambio en el gradiente electroquímico de H+. Este cambio afecta al motor flagelar.
3) Las quimiotaxias, especialmente las de Enterobacterias, son las taxias mejor estudiadas. Las abordaremos a continuación con cierto detalle.
Cuando se coloca a una bacteria en un gradiente de estímulo químico se observa a lo largo del tiempo una respuesta con 3 fases distintas:
|
fase de latencia (que dura unos 0.2 seg.), en la que el patrón de rotación no se modifica. | |
|
rápida excitación (medida aquí como la probabilidad de encontrar al rotor girando en sentido CAR). | |
|
fase de adaptación lenta, hasta que se restablece el patrón inicial. |
El comportamiento de quimiotaxia se pone en marcha cuando un estímulo químico determinado (un quimioefector) se une en la superficie bacteriana a un receptor específico, lo que a su vez desencadena un proceso de transducción intracelular de esta señal, que finalmente llega al complejo conmutador del corpúsculo basal flagelar, lo que cambiará las proporciones iniciales de giro en sentido CAR y AR. Si el quimioefector produce una taxia positiva, se denomina quimioatrayente, mientras que si desencadena una taxia negativa se denomina quimiorrepelente.
|
El sistema sensorial de la bacteria, ante un gradiente espacial de atrayente o repelente, origina una migración neta (acercamiento o alejamiento, respectivamente) haciendo que la duración de una carrera en la dirección favorable sea mayor, y para ello influye sobre el conmutador flagelar binario que determina el sentido de rotación. | |
|
La bacteria capta ese gradiente espacial, detectándolo de hecho como si fuera un gradiente temporal autogenerado por ella misma mientras va moviéndose. Como veremos, la bacteria compara, mediante el mismo receptor de membrana que captó el estímulo, la concentración actual de la sustancia con la que tenía en los segundos anteriores. | |
|
Además, la bacteria vuelve al patrón aleatorio de movimiento tras varios segundos o minutos del contacto inicial con el gradiente: existe un mecanismo de adaptación al estímulo que, como veremos, implica una modificación covalente de los receptores. |
Estos son los aspectos que vamos a pasar a considerar a continuación.
En enterobacterias se ha estudiado bien la quimiotaxis dependiente de un tipo de proteínas sensoras de estímulos químicos denominadas MCP, acrónimo inglés de “proteínas quimiotácticas aceptoras de metilo”, o simplemente transductores. En Escherichia coli se han identificado cinco MCP, y cada una responde a un conjunto determinado de quimiatrayentes y/o quimiorrepelentes. Por ejemplo, la MCP llamada Tar detecta los atrayentes aspártico y maltosa y los repelentes cobalto y níquel.
Todas las MCP son proteínas integrales de membrana citoplásmica, con un dominio periplásmico preparado para unirse a los quimioefectores y un dominio citoplásmico dotado a su vez de dos zonas funcionales: una de ellas es la región transductora que genera la señal intracelular que va a llegar al motor flagelar, y la otra es la región metilable, con varios glutámicos que pueden aceptar radicales metilo (-CH3).
Los transductores MCP transmiten información al flagelo por medio de una cascada de transducción intracelular de la señal, en la que están implicadas seis proteínas: CheA, CheW, CheY, CheZ, CheR y CheB.
|
CheA: Es una proteínquinasa que se autofosforila en una His concreta cuando el MPC se une a un quimioefector. Es el regulador central del sistema quimiotáctico, ya que en su forma fosforilada (CheA-P) fosforila a CheY y a CheB. | |
|
CheW: es necesaria para el acoplamiento entre CheA y el dominio citoplásmico del MCP. | |
|
CheY: la proteína CheY es fosforilada en un determinado aspártico por la CheA-P, y en su forma CheY-P interacciona con el conmutador del anillo C del flagelo, lo cual incrementa la probabilidad de una inversión del giro desde el CAR al AR, con lo que aumenta la probabilidad de virajes. | |
|
CheZ: contrarresta la señal de viraje al facilitar la desfosforilación de CheY-P en CheY. | |
|
CheR: es una metil-transferasa que cataliza la transferencia de grupos metilo desde la S-adenosil-metionina (SAM) hasta los glutámicos del dominio citoplásmico del MCP. | |
|
CheB: cuando esta proteína es fosforilada por la CheA-P, se convierte en una metilasa (CheB-P) que retira los metilos previamente unidos a los glutámicos del MCP. |
Como veremos, la “memoria celular” para que la bacteria detecte gradientes de concentración en función del tiempo es el resultado de la metilación de las MCP por la CheR, y de su desmetilación por CheB-P.
1. En un ambiente neutro (ausencia de estímulo), la MCP tiene un nivel basal de metilación (una media de un solo glutámico metilado en su dominio citoplásmico). En esta situación, la CheA tiene un nivel basal de fosforilación, que sirve para fosforilar a CheY y a CheB. El motor flagelar presenta un patrón de giro de unos cuantos segundos en sentido CAR (à natación en línea recta), y breves períodos de sentido AR (à virajes), que es la base del movimiento aleatorio de la bacteria. Ahora veremos cómo este flujo basal de información hacia el flagelo y de metilación del MCP se altera con una sustancia atrayente.
2. Cuando añadimos el atrayente, éste se une al dominio periplásmico del MCP, lo que provoca un cambio conformacional que se transmite hasta el dominio citoplásmico, de modo que se produce una modificación de la región efectora de este dominio que transmite la señal hacia el motor flagelar. El tiempo que tarda en llegar al motor explica el periodo de latencia. Durante esta fase el nivel de metilación no se altera, pero el cambio conformacional deja “activados” a los glutámicos metilables.
3. Transducción intracelular de la señal: el cambio conformacional del dominio citoplásmico tiene el efecto de inhibir la activación de la CheA, de modo que desciende el nivel basal de su autofosforilación, lo que se traduce en que se fosforilan menos moléculas de CheY y de CheB. Al haber menos CheY-P, llegan menos señales al conmutador flagelar de que cambie a sentido igual al de las agujas del reloj. Por lo tanto, se prolongan los períodos de natación en línea recta (y es más probable que la bacteria se acerque al estímulo químico).
4. Mientras tanto, ha estado actuando la metiltransferasa (CheR), que ha ido añadiendo metilos a los glutámicos del dominio citoplásmico de la MCP. Si pasa un cierto tiempo y el dominio periplásmico sigue ocupado por el quimioatrayente, se alcanza un gran nivel de metilación en ese dominio citoplásmico. Esto hace que el dominio efector citoplásmico vuelva a una configuración “nula”, o sea, deja de emitirse señal excitadora. A ello colabora igualmente que el nivel de metilesterasa (la proteína CheB-P, es decir la forma fosforilada) sea bajo. Esta es la explicación molecular de por qué ocurre al cabo de unos segundos la adaptación lenta al estímulo. Como la metilación es relativamente lenta, esto significa que si en un determinado momento la concentración actual de quimioefector (detectada por el grado de ocupación del dominio periplásmico) es similar a la concentración unos segundos antes (manifestada por el nivel de metilación del dominio citoplásmico), la bacteria “sabe” que lleva ya un cierto tiempo acercándose al estímulo. Si la metilación se ha estabilizado a un nivel alto, se produce un cambio conformacional por el que el MCP deja de emitir señal (estado nulo), y la bacteria se ha adaptado al estímulo.
Como ejercicio, veamos qué pasaría si ponemos un repelente: la unión del repelente al MCP provoca un cambio conformacional que hace que el dominio citoplásmico interaccione ahora con el complejo CheW·CheA de modo que se aumenta la tasa de autofosforilación de CheA. Ahora esta CheA-P fosforila tanto a CheY como a CheB. La CheY-P difunde a la base del flagelo e interacciona con el conmutador (anillo C), y "da la orden" de que se cambie más a menudo a giro en sentido de las agujas del reloj (AR), lo que hace que la bacteria vire caóticamente más a menudo. Con ello aumentan sus probabilidades de que encuentre una dirección de natación más favorable (en sentido opuesto al gradiente), en cuyo caso tendríamos un patrón similar a cuando se une un atrayente. Mientras tanto, la CheR ha encontrado más difícil acceder a los glutámicos, y el mayor nivel de la metilesterasa (CheB-P) hace que se eliminen metilos.
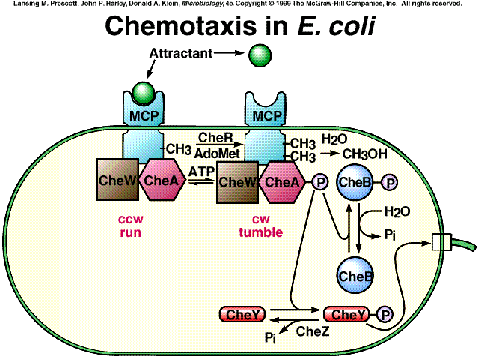 |
Esquema del funcionamiento del sistema de transducción de la señal de un quimioatrayente (lee el texto para una explicación completa) |
Son un tipo de flagelos que presenta exclusivamente el grupo de las Espiroquetas. Estas bacterias Gram-negativas son extremadamente finas y de forma helicoidal. Están compuestas de:
|
cilindro protoplasmático, formado por el protoplasto rodeado de la capa de peptidoglucano. El sáculo de mureína de este PG tiene forma helicoidal, y es responsable de la típica morfología de estas bacterias; | |
|
membrana externa; | |
|
entre el cilindro protoplasmático y la membrana externa se encuentran los peculiares flagelos, insertados subpolarmente y enrollados alrededor del cilindro. Estos flagelos se denominan flagelos periplásmicos (= endoflagelos = fibrillas axiales). |
Estructura: Cada flagelo, en sí mismo, es similar al tipo de flagelo clásico ya estudiado:
|
corpúsculo basal, con dos pares de anillos (excepto en Leptospira, con sólo un par); | |
|
codo | |
|
filamento, a base de subunidades de flagelina. |
Ahora bien, lo característico es la disposición de los flagelos que salen de cerca de cada extremo, en relación con el cuerpo celular:
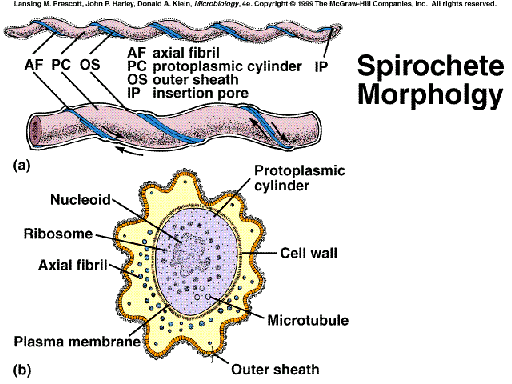 |
Esquema de los flagelos periplásmicos de las espiroquetas |
|
En la mayoría de las especies, cada flagelo se extiende a lo largo del eje bacteriano, paralelo a la superficie del cilindro protoplasmático, hasta alcanzar los 2/3 de la longitud total; esto se traduce en que los flagelos que salen de cada extremo se solapan en la zona central (la excepción la tenemos en el gén. Leptospira, en que no se solapan). | |
|
Las distintas fibrillas provenientes de cada extremo discurren paralelas y cercanas. El conjunto de estas fibrillas se manifiesta como filamento axial, recubierto por membrana externa. |
Obsérvese en el esquema el corte transversal de Cristispira, con sus numerosas fibrillas (=flagelos) axiales, que conjuntamente determinan un filamento axial prominente (cresta), envuelto, por supuesto, en membrana externa.
Papel de los endoflagelos en la movilidad de las espiroquetas
Los flagelos de estas bacterias, paralelos al eje longitudinal de la célula, están anclados al cilindro protoplasmático, que es rígido (mientras que la membrana externa es flexible). Al girar los flagelos de los dos extremos en el mismo sentido, obligan a girar al cilindro rígido en un sentido, y a la membrana externa en sentidos contrarios. El efecto es que el cilindro protoplasmático gira en torno del filamento axial formado por los flagelos periplásmicos. Esta es la base de los distintos tipos de movimientos que podemos observar en estas bacterias:
|
En medios líquidos se mueven
| |||||
|
Sobre la superficie de medios sólidos:
|
Todos estos tipos de movimiento son adaptaciones evolutivamente conseguidas que permiten el rápido avance en medios de alta densidad (fangos espesos, mucosas de los animales, etc), medios donde los flagelos típicos ya no pueden servir adecuadamente. La evolución ha hecho que las espiroquetas se adapten, por su peculiar estructura y la de sus flagelos, a medios muy viscosos: de hecho, se mueven con mayor rapidez a 300-500 cP que a 10-50 cP. Presentan, además taxias positivas hacia esos medios viscosos.
|
Son apéndices filamentosos rectos y rígidos, más cortos y más finos (3-10 nm de diámetro) que los flagelos, y que aparecen en muchas bacterias (sobre todo Gram-negativas). La mayoría están compuestos por un solo tipo de proteína (la pilina), de unos 17-25 kDa, cuyas subunidades se disponen en una matriz helicoidal que deja un pequeño hueco central. | |||||
|
Están implantados a nivel de membrana citoplásmica. | |||||
|
Número variable: desde 1 a varios cientos o miles por célula. | |||||
|
Disposición: alrededor de todo el perímetro celular, y a veces, de inserción polar. | |||||
|
Aislamiento: por simple agitación mecánica de las células, seguido de ultracentrifugación. | |||||
|
Composición: ensamblaje de subunidades de pilina, proteína globular muy hidrófoba. | |||||
|
Ensamblaje: inserción de subunidades de pilina en la base del pelo en crecimiento, a partir de pre-pilina, que se procesa por escisión del correspondiente péptido-líder a su paso por la membrana citoplásmica. | |||||
|
Existen dos tipos principales de pili (pilus, en singular):
|
Son pelos de 4 a 7 nm de diámetro (según especies), repartidas por toda la superficie y que funcionan como adhesinas, es decir como estructuras para la adhesión a sustratos vivos o inertes. Condicionan varias propiedades biológicas, derivadas de sus propiedades adhesivas:
|
microcolonias y velos (los velos son películas formadas por acúmulos de bacterias en medios estáticos -en reposo-). | |||||
|
adhesión a superficies inertes | |||||
|
adhesión superficies vivas. En el caso de bacterias patógenas, esta capacidad tiene que ver con su virulencia, invasividad del tejido. Ejemplos de función como adhesinas:
|
La función de adhesina no reside en la pilina que constituye la inmensa mayoría de la fimbria, sino en una proteína especial de la punta del pelo. La mayoría de estas proteínas de la punta pertenecen a la clase de las llamadas lectinas, es decir, proteínas o glucoproteínas capaces de unirse con gran afinidad a cadenas laterales de polisacáridos presentes en la membrana citoplásmica de las células del hospedador a las que se adhieren.
Aspectos genéticos:
|
Los genes codificadores de las proteínas de los pelos adhesivos son de localización cromosómica. | |
|
En muchas bacterias patógenas se da un fenómeno de variación de fase: se trata de cambios rápidos y reversibles por los que células piliadas (Fim+) pueden convertirse en no piliadas (Fim--), y viceversa. El significado adaptativo es que los individuos Fim+ son los más capaces de iniciar la colonización del animal hospedador, pero son más sensibles a la fagocitosis, mientras que una vez que han colonizado el epitelio, el cambio a Fim-- permite que los individuos resistan mejor la fagocitosis. | |
|
Pero además, existe otro interesante mecanismo adaptativo: las células Fim+ de algunas especies experimentan fenómenos de variación antigénica, es decir, por una serie de mecanismos genéticos, cambian la especificidad antigénica de su pilina, lo que supone una estrategia de evitación contra el sistema inmune del hospedador (un caso más de esa “carrera de armamentos” evolutiva que se libra entre microorganismos y organismos superiores). |
Algunas pilinas (por ejemplo, en los géneros Moraxella y Neisseria) sirven también como parte del aparato necesario para la transformación genética por ADN exógeno.
Son más largos y más gruesos (unos 10 nm de diámetro) que las fimbrias adhesivas. Aparecen en menor número (de 1 a 10 por célula), y su función es la de permitir los contactos iniciales en la conjugación, como órgano de reconocimiento entre la bacteria donadora, dotada del pelo sexual, y la receptora, carente de él. Sus genes son de localización plasmídica.
Hay dos clases principales de pelos sexuales: los de de tipo F y los de tipo I, cada uno con un tipo de proteína distinta (genéricamente conocida como pilina sexual). Son usados como receptores específicos por parte de algunos fagos.
Hablaremos de los pelos sexuales cuando abordemos el capítulo de Conjugación bacteriana.
Son prolongaciones semirrígidas vivas, propias de ciertas bacterias, con un diámetro menor que el cuerpo celular. Es decir, son apéndices del cuerpo celular rodeados por membrana y pared celulares.
Funciones:
1) En algunas bacterias prostecadas funcionan en la reproducción (prostecas reproductivas o “hifas”). Ejemplos: Hyphomicrobium, Hyphomonas.
2) En Caulobacter actúa como apéndice para unión a sustratos inertes o para la formación de rosetas de varios individuos, merced al botón de anclaje situado en el extremo
3) En general, suponen un modo de aumentar la relación superficie/volumen, lo cual redunda en:
a) mayor capacidad de flotabilidad para ciertas bacterias planctónicas;
b) mayor superficie para la captación de nutrientes en ambientes oligotróficos.
Ejemplos: Ancalomicrobium, Prosthecomicrobium, Stella, etc.
Son estructuras filamentosas no vivas, terminadas en botones de anclaje (discos adhesivos), producidas por secreción continua de materiales polisacarídicos en una zona concreta de la superficie bacteriana.
Función: Permite la unión de ciertas bacterias de hábitats acuáticos a sustratos sólidos, vivos o no.
Ejemplos:
|
Gallionella: es una bacteria con forma de media luna, de cuyo lado cóncavo surgen de 3 a 40 filamentos helicoidales, terminados en botones de anclaje. | |
|
Planctomyces: es una bacteria con forma de pera, con flagelo subpolar, que pasa parte de su vida anclada a sustratos por medio de un tallo constituido por numerosas fibras rectas.
|
![]()
![]()
Otras partes de esta web: