|

Productos naturales orgánicos

Introducción

Origen y Aplicaciones

Nomenclatura

Clasificación basada en:

- Estructura Química

- Actividad fisiológica

- Taxonomía

- Biogénesis

Tipos de Metabolitos:

- Primarios

- Secundarios

Biogénesis de:

- terpenoides

- aminoácidos

- fenilpropanoides

- ácidos grasos
|
|

 |
 |
 |
 |
|
Biogénesis de terpenoides |
|
 |

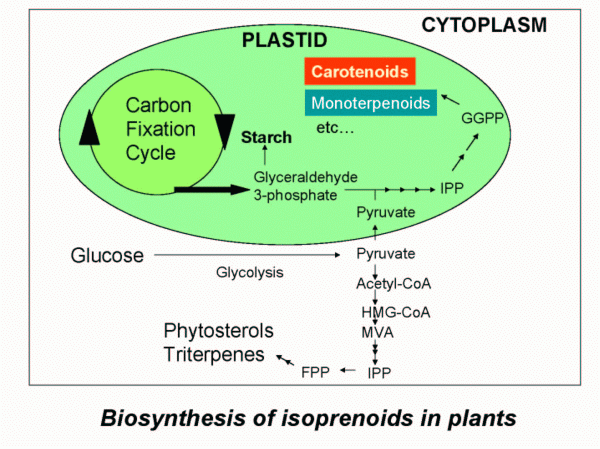
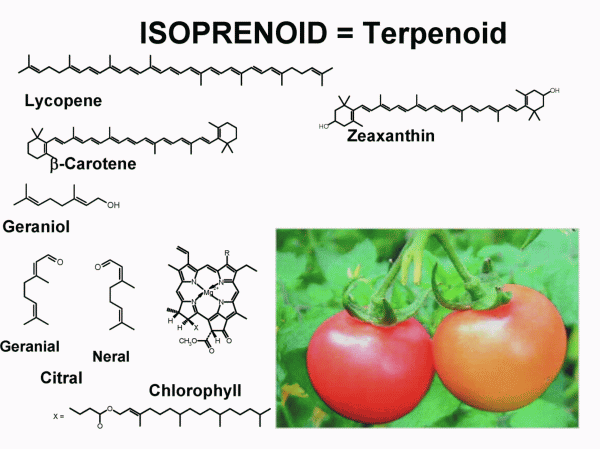
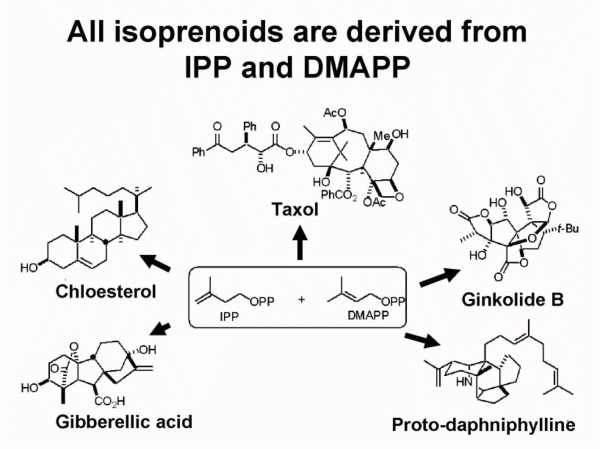
Los terpenoides son a menudo llamados isoprenoides teniendo en cuenta que el isopreno es su precursor biológico. Presentan una gran variedad estructural, derivan de la fusión repetitiva de unidades ramificadas de cinco carbonos basadas en la estructura del isopentenilo, son monómeros considerados como unidades isoprénicas y se clasifican por el número de unidades de cinco carbonos que contienen en mono, sesqui, di, tri, tetraterpenos,…. Los productos que provienen del metabolismo del isopreno abarcan a los terpenos, los carotenos, las vitaminas, los esteroides, etc.
La biogénesis de los terpenoides se puede dividir en cuatro etapas generales, que son:
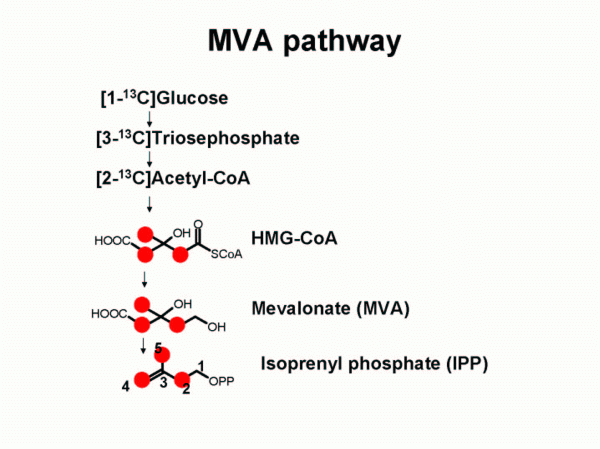
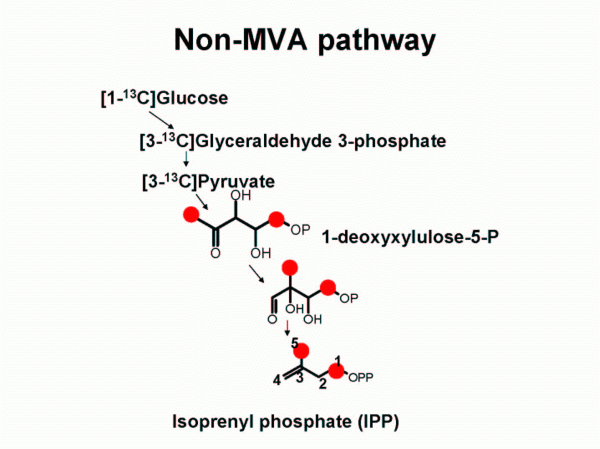
- Etapa 1: Síntesis del isopentenilpirofosfato (IPP): Vía ácido mevalónico (MVA) o vía no de ácido mevalónico o vía de 1-desoxi-D-xilosa-5-fosfato (DOXP).
- Etapa 2: Isomerización del IPP a dimetilalilpirofosfato (DMAPP), adición repetitiva de IPP y DMAPP.
- Etapa 3: Elaboración de moléculas de prenilpirofosfato.
- Etapa 4: Modificaciones enzimáticas de los esqueletos.

|
|
|
Etapa 1: Síntesis del isopentenilpirofosfato (IPP) vía ácido mevalónico (MVA) |
|

- Ruta del ácido mevalónico (MVA): Esta vía opera en el citosol y en el retículo endoplasmático de las plantas y se encuentra también en animales,
levaduras, bacterias, hongos, algas y protozoos.
- Ruta de la 1-desoxi-D-xilulosa-5-fosfato (DOXP): Se presenta sólo en bacterias, algas verdes, cloroplastos de las plantas y parásitos plasmodium.
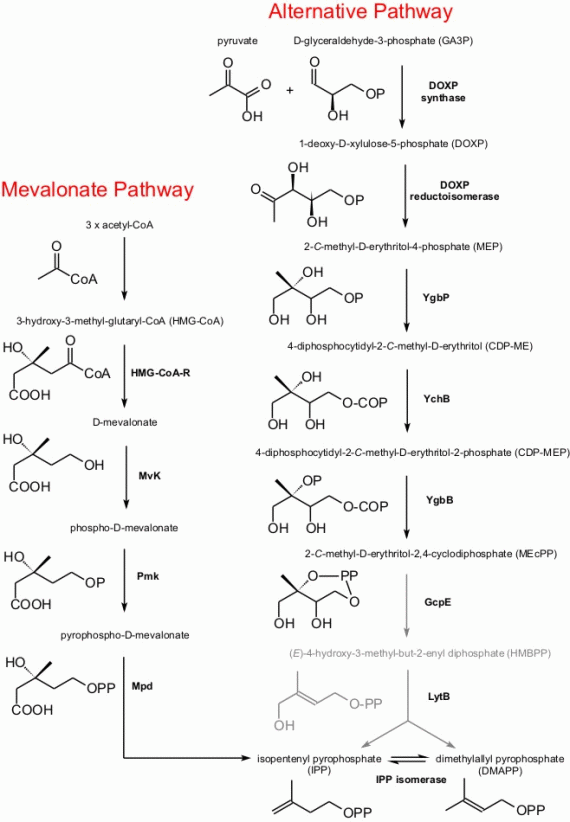
|
|
|
Etapa 2: Isomerización del IPP a dimetilalilpirofosfato (DMAPP), adición repetitiva de IPP y DMAPP. |
|

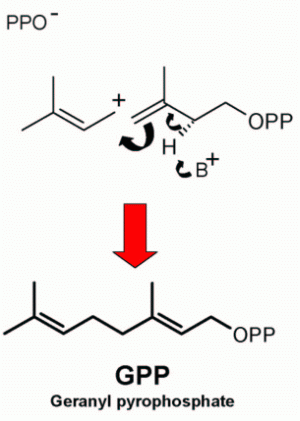
La IPP isomerasa convierte IPP en DMAPP, éste acepta sucesivos residuos de IPP para formar geranil pirofosfato (GPP), farnesil pirofosfato (FPP),
geranil geranil pirofosfato (GGPP). Una prenil transferasa cataliza la transferencia de IPP en un receptor de grupo prenilo cía una sustitución nucleofílica.
La isomerización de IPP a DMAPP crea un doble enlace alílico, a partir del cual se generan carbocationes estabilizados por resonancia.
La adición repetitiva de IPP a DMAPP tiene lugar mediante diferentes prenil transferasas y esta adición puede ocurrir por reacciones cabeza-cola,
cabeza-cabeza o cabeza-centro.
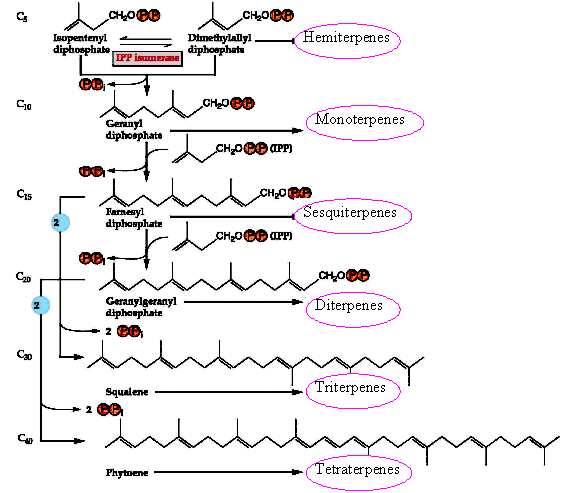
|
|
|
Etapa 3: Elaboración de moléculas de prenilpirofosfato. |
|

Una gran familia de sintetasas es responsable de la conversión de GPP, FPP y GGPP en unidades de isoprenilo que posteriormente darán lugar a todos
los terpenoides mediante la intervención de otras sintetasas y ciclasas.

|
|
|
Etapa 4: Modificaciones enzimáticas de los esqueletos. |
|

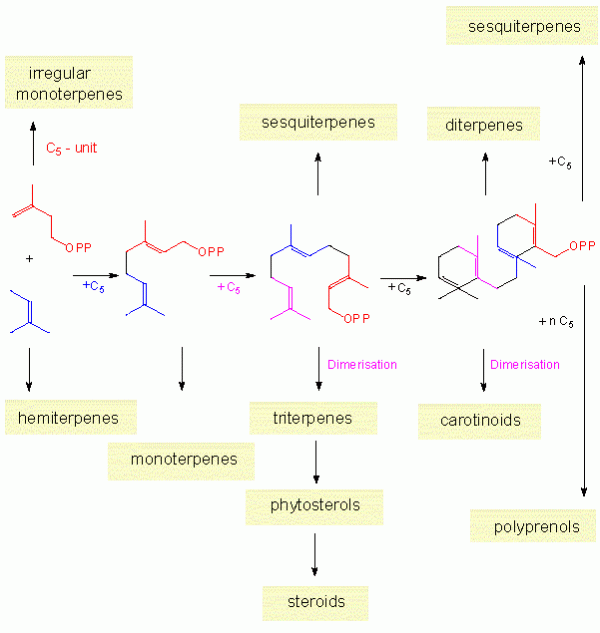
- Monoterpenos (C-10): Los hay como moléculas de cadena abierta y con forma cíclica; se dan por ciclación de GPP mediante la intervención de las
monoterpeno sintetasas y en este grupo de productos naturales son frecuentes las excepciones a la regla de unión cabeza-cola (piretrinas).
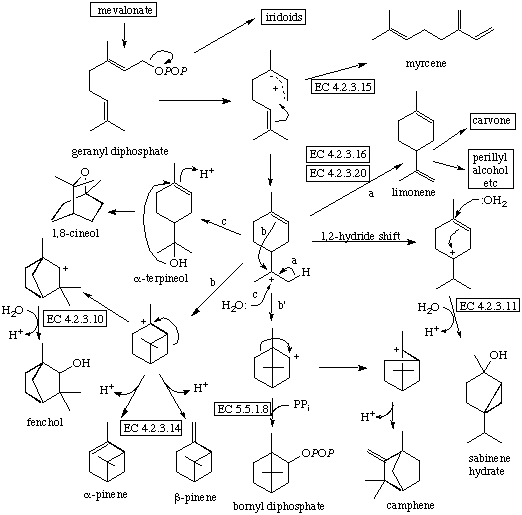
Así aparecen esqueletos monoterpénicos como: mierceno (cadena abierta), cineol, terpineol, fenchol, carveol, etc.
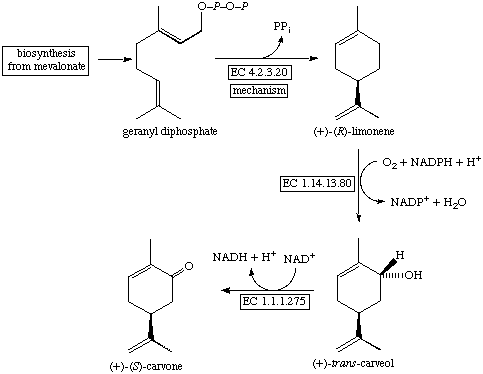
- Sesquiterpenos (C-15): Es un amplio grupo de terpenoides que presenta más de 200
estructuras cíclicas diferentes; las ciclación del FPP ocurre por el
mismo mecanismo que la ciclación del GPP; los cinco carbonos y el doble enlace adicional permiten un aumento de la flexibilidad de la cadena y la formación
de un mayor número de estructuras esqueletales; muchos de estos sesquiterpenos tienen funciones de defensa en plantas y algunas sesquiterpeno sintetasas
con capaces de dar lugar a más de 25 productos diferentes.
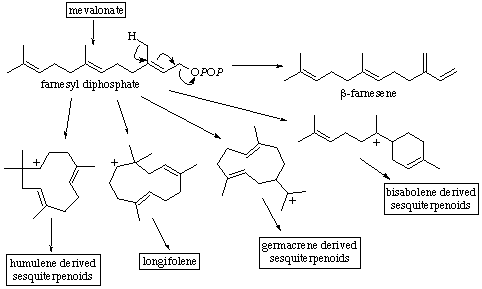
Los esqueletos más frecuentes de sesquiterpenos que se obtienen son: farneseno (cadena abierta), humuleno, longifoleno, germacreno y bisaboleno.
- Diterpenos (C-20): Las diterpeno sintetasas ciclan GGPP vía dos tipos de mecanismos;
a) intermedio catiónico similar a las prenil sintetasas (taxadieno sintetasa);
b) Intermedio de ion carbonio; los diterpenos se encuentran en muchos casos como fitoalexinas y giberelinas.
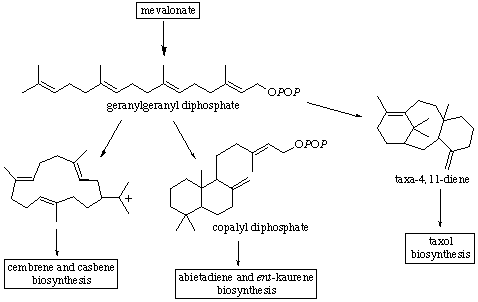
En este grupo de terpenoides se incluyen compuestos con esqueletos de cembreno, casbeno, gibano, abietadieno, ent-kaureno, taxadieno y taxol.
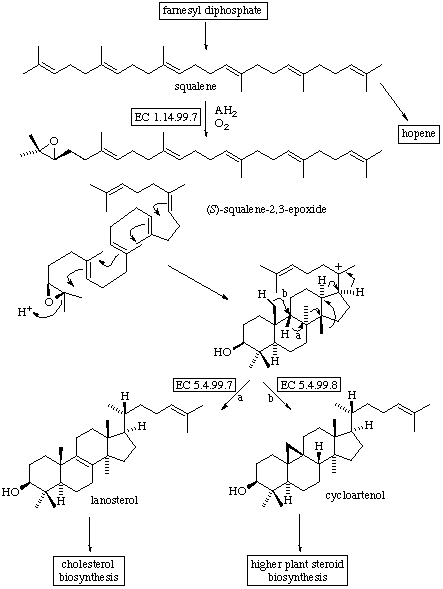
- Triterpenos (C-30): Para su formación hay oxidación y uniones cabeza-cabeza;el esquema general será: FPP + FPP —> escualeno —> óxido escualeno —> triterpenos;
existen diferentes mecanismos de ciclación y directamente relacionados con ellos se encuentran los esteroides, las hormonas y las sapogeninas.
- Tetraterpenos (C-40): Los mecanismos son similares a los de síntesis de triterpenos y su formación ocurre mediante la intervención de la fitoeno sintetasa
y el siguiente esquema general: GGPP + GGPP —> fitoeno —> carotenoides.
|
|
|
Formación de otros Esqueletos de Isoprenoides |
|

Las terpeno sintetasas dan lugar a esqueletos básicos parentales; raramente las fenil transferasas y las terpenos sintetasas dan productos que
sean funcionalmente diferentes. Hay transformaciones secundarias como: oxidación, reducción, isomerización, conjugación, hidroxilación, epoxidación,
desmetilación, hidratación etc.
La nomenclatura los diferentes enzimas que catalizan las reacciones biogenéticas de los productos naturales viene establecida por el NC-IUBMB
(Nomenclature Committee of the International Union of Biochemistry and Molecular Biology), junto con la la normativa
para dicha descripción y los nombres de los distintos enzimas que intervienen en los procesos biogéneticos que se detallan.
En este apartado final de la biogénesis de isoprenoides se detalla la formación de los compuestos superiores que en muchos casos conlleva la variación
de esqueletos.
- Epoxidación del escualeno. Biogénesis de lanosterol y cicloartenol: Este proceso comienza con la ciclación del escualeno cuando hay presentes oxígeno molecular,
NADPH y las fracciones soluble y microsomal de hígado. La epoxidación del escualeno comienza con la incorporación de oxígeno molecular y es catalizada por una
monooxigenasa, concretamente, la escualeno epoxidasa. En la segunda reacción, que ocurre en animales y hongos, interviene la lanosterol sintetasa,
una ciclasa que cataliza la ciclación conduce al triterpeno lanosterol. Esta segunda reacción, en plantas trnascurre por una vía diferente, es catalizada
por la cicloartenol sintetasa y se obtiene el triterpeno cicloartenol.
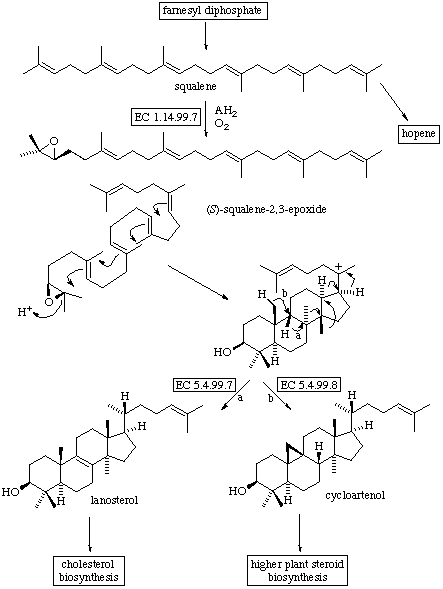
- Biogénesis de los distintos esqueletos de triterpenos: Partiendo del escualeno y por ciclación se forman los diferentes anillos del treiterpeno.
Así ocurre, por ejemplo para la formación del esqueleto de hopaeno.
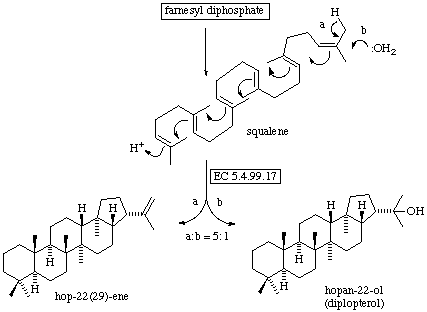
En sendos esquemas se aprecia, además de la formación de otros esqueletos a partir
del escualeno, la interrelación entre los diferentes esqueletos triterpénicos.
- Biogénesis de colesterol: El esquema general de la biosíntesis del colesterol parte del acetil-CoA y llega hasta el lanosterol por los esquemas
biogenéticas antes comentados.
Desde el lanosterol ocurren las siguientes de reacciones que conducen hasta el colesterol: desmetilación, descarboxilación,
migración y reducción de dobles enlaces. Esto supone unas modificaciones sobre el esqueleto de lanosterol, se pueden dividir en tres partes diferentes:
anillo A, los anillos B, C y D, y en la cadena lateral.
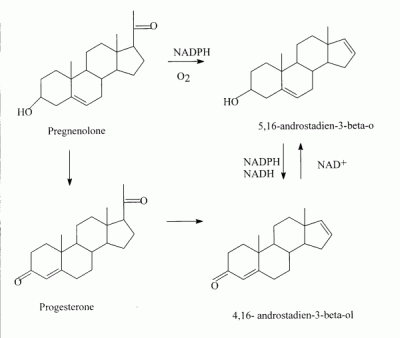
- Biogénesis de esteroides: Existen tres etapas básicas para la formación de esteroides, la primera, y ya comentada, es la formación de colesterol
a partir de acetato, la segunda incluye la producción de compuestos que son precursores inmediatos para formar los esteroides, y la etapa final consiste
en ligeras alteraciones para producir los esteroides.
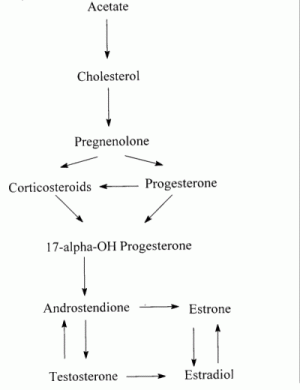
El esquema general de la formación de esteroides comienza en el acetato, llega al colesterol y a
partir de aquí se forman los estrógenos, los andrógenos y los corticoides adrenales.
- Biogénesis de carotenoides: Los carotenoides son tetraterpenos originados por las vías de mevalonato o de la desoxyxilulosa fosfato y
la biogénesis de los diferentes tipos de ello se hace a través de un complejo esquema general. La primera etapa en la vía que conduce a los
carotenoides es la formación de fitoeno por la enzima fitoeno sintetasa y a partir de aquí, a través de otros intermedios, que son isomerizados
hasta llegar al todo-trans licopeno. Desde este carotenoide todo abierto, se producen ciclaciones y funcionalizaciones que conducen a otros
carotenoides como alfa, y delta-caroteno, luteína, crocetina, etc. La formación de retinal, vitamina A, responsable del proceso de visión,
tiene lugar a partir los carotenoides por intervención de una beta-caroteno monooxigenasa que divide a la molécula de 40 carbonos mediante una oxidación central.
|
|
|
|
|
|
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()