telf: 958.243316
2. Determinación del equivalente-gramo del magnesio
2.1. IntroducciÓn:
En las reacciones de oxidación reducción se define equivalente químico como la masa de una sustancia expresada en gramos capaz de aceptar o ceder un mol de electrones.
Para calcular experimentalmente el “equivalente gramo del Mg” llevaremos a cabo la reacción completa de una masa conocida de magnesio con ácido clorhídrico (HCl). Al finalizar la reacción, donde el HCl se empleará en exceso, la cantidad de H2 producido será proporcional a la cantidad de Mg utilizado. La masa de hidrógeno producida se calculará a partir su volumen, el cual recogeremos en un tubo de vidrio graduado como se indicará a continuación, y utilizando para el cálculo la ecuación de los gases ideales. Conocida la masa total de Mg empleada en la reacción, se deducirá fácilmente la masa en gramos de Mg que se necesita para liberar 1 átomo-gramo de hidrógeno; este valor se conoce como “equivalente gramo del Mg”.
2.2 Parte Experimental:
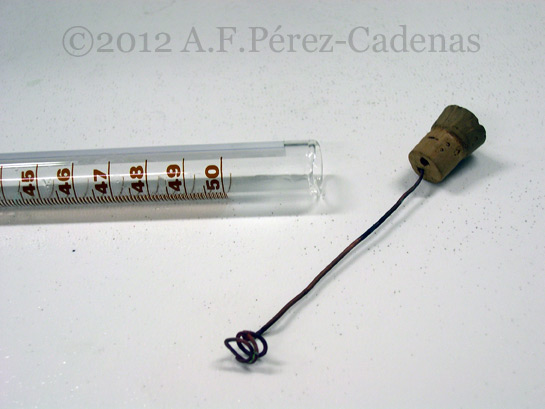
Para llevar a cabo esta experiencia es necesario disponer de un tubo graduado cerrado por uno de sus extremos, y con un tapón de corcho adaptado como el que se muestra en la fotografía, que se situará en el extremo abierto de dicho tubo. Este tapón tiene ajustado un alambre de cobre acabado en espiral, sobre la cual se enganchará la cinta de magnesio, y además, contiene un orificio que permite el paso de fluidos.
Comenzaremos pesando un trozo de 2 a 3 cm de cinta de Mg, la cual doblaremos y fijaremos a la espiral de cobre.
Dentro del tubo graduado verteremos aproximadamente 6 mL de HCl 8M; conviene hacerlo con el tubo inclinado para favorecer que el líquido resbale.
Posteriormente y con cuidado, completamos de llenar el tubo con agua procurando no moverlo para evitar, en la medida de lo posible, la mezcla entre ambos líquidos. Mientras se vierte el agua, esta arrastrará hacia abajo el HCl que haya quedado adherido sobre las paredes del tubo, de forma que la boca del tubo quede limpia de él. No deben de quedar burbujas adheridas, por lo que podemos golpear suavemente para su expulsión. Una vez que el tubo está completamente enrasado con agua y libre de burbujas se cerrará con el tapón que contiene la cinta de Mg.
No ha de quedar burbuja alguna de aire tras el cierre. La espiral con el Mg quedará en el extremo del tubo donde en un principio solo hay agua, por lo tanto en este momento todavía no habrá comenzado la reacción.
A continuación invertiremos el tubo e introduciremos su extremo con el tampón en un recipiente con agua, en posición vertical, y sujetándolo a un soporte. Esta maniobra acelerará la difusión del HCl que entrará en contacto con el Mg.
Al difundirse el ácido se inicia la reacción observándose claramente la formación de gas, hidrógeno.
Una vez finalizada la reacción, lo cual se detecta por el cese del desprendimiento gaseoso se golpea el tubo suavemente para que asciendan todas las burbujas adheridas.
Finalmente mediremos el volumen de gas recogido en el tubo para lo cual procederemos a tapar el orificio del tapón e introducir de nuevo verticalmente el tubo, en este caso, dentro de una probeta llena de agua.
Cuidamos de enrasar el nivel de líquido interior de la bureta con el nivel de líquido exterior. Así nos aseguramos de medir el volumen de hidrógeno generado a presión atmosférica.
Para poder calcular en número de moles de H2 formados empleando la ecuación de los gases ideales, tenemos que anotar además la temperatura del agua, la temperatura y presión atmosférica en el laboratorio, y la presión de vapor del agua a esa temperatura, necesarias para conocer la presión real de hidrógeno. Debemos repetir el proceso dos veces para obtener un valor promedio.
2.3 Ejemplo:
Cantidad de Mg 0,021 g Temperatura del agua 21 ºC Temperatura del laboratorio 21 ºC Presión atmosférica en el laboratorio 705 mm Hg Presión de vapor del agua a 21ºC 19,827 mm Hg Volumen de hidrógeno 0,0248 L Peso equivalente del Mg 11,17 Error relativo 8,14
reaCciÓn:
Mg + 2HCl → MgCl2 + H2
Oxidación: Mg → Mg2+ + 2e E°= 2,356 v Reducción: 2H+ + 2e → H2 E°= 0,000 v E°= E°cátodo- E°ánodo = 2,356 v
La reacción se produce espontáneamente:
ΔG° = –n·F·E° = –2·96.480·2,356 = - 450.372,96 J/mol
cÁlculos:
Phidrógeno=Patm–Pvapor de agua= 705 - 19,827 = 685,173 mm Hg
P·V = n·R·T → n =P·V R·T=(685,173/760)·0,0248 0,082·295,15= 9,238·10-4 mol H2
9,238·10-4mol H2 x2 g H2 1molH2= 0,000188 g H2
n° Eq Mg = n° Eq H2 ;gMg PeqMg=gH2 PeqH2; PeqH2 = 1g / Eq
PeqMg =gMg gH2x PeqH2 =0,021 0,00188= 11,17 g/Eq
Error:11,17 – 12,15 12,15x 100 = 8,14 %
2.4. Formulario de Auto-evaluación
Aquí se encuentra el formulario de preguntas que debes rellenar y enviar por correo electrónico a tu profesor: