METODOS |
Tinciones |
||
| Tinción de ácido-alcohol resistencia (técnica de Kinyoun modificada) | Encontrará información más completa sobre los componentes específicos de las paredes de las bacterias ácido-alcohol resistente en los apuntes on line del Profesor E. Iañez |
||
| Fundamento: envuelta |
Las bacterias ácido alcohol resistentes son bacterias Gram positivas que resisten la decoloración con decolorantes enérgicos, como las soluciones de etanol en ácido clorhídrico (de donde deriva la denominación). |
||
| Ácidos micólicos | Esta resistencia se debe a ácidos grasos específicos de la pared (ácidos micólicos). Los ácidos se encuentran esterificando hidroxilos de glúcidos de diferente tamaño. Pulsa aquí para ver el esquema de la pared celular |
||
| Hidrofobia | El resultado es la formación de una pared lipídica (hidrófoba). En consecuencia la pared dificulta la difusión de moléculas hidrofílicas (nutrientes y colorantes)a través de su envuelta celular |
||
| Grumos en los cultivos | El aspecto de los cultivos sobre medios sólidos es característico: se forman grumos (en la imagen a la izquierda cultivo de Mycobacterium smegmatis y a la derecha de E. coli). |  |
|
Grumos al microscopio 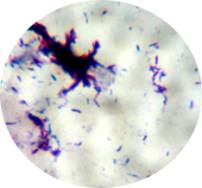 |
Si las bacterias AAR no se extienden con fruición, quedan agrupadas dificultando la definición de su forma (en ambas imágenes cultivos de M. smegmatis). | |
|
| Crecimiento lento | La impermeabilidad a moléculas hidrofílicas determina un crecimiento (lento) característico (formación de grumos) y la dificultad de tinción por colorantes convencionales, pero como las endosporas, una vez teñidas son difíciles de decolorar | ||
| Alteración de la envuelta con calor o con fenol | Solo se tiñen bien forzando la tinción (con calor como en la endospora o con una solución muy concentrada de colorante (fuchina) en fenol). | ||
| Alcohol-clorhídrico | El Alcohol-clorhídrico no las decolora, por lo que se observan de color rojo. Cualquier otra célula (excepto de algunas Nocardia, o endosporas) es decolorada, por lo que admite la tinción por un segundo colorante (azul de metileno) . | ||
| Azul de metileno | |||
| Modalidades | Puede hacerse según dos técnicas: tinción de Ziehl-Neelsen o tinción de Kinyoun | ||
| Material necesario | Cultivos de Mycobacterium smegmatis o de M. phlei. Fuchina básica (fuchina (1 g), fenol (5 g), etanol (15 ml) y agua destilada 100 ml). Etanol-HCl : HCI 12N (3 ml), agua destilada 100 ml. | ||
| Método: tinción de Kinyoun modificada) | Teñir con fuchina durante 2 minutos. Lavar con agua |
|
|
| Decolorar con etanol-HCI . Lavar con agua |
|
||
| Teñir con azul de metileno durante 1 minuto. Lavar con agua. Observar con objetivo de inmersión |
|
||
| Resultado | Las bacterias ácido-alcohol resistente se ven de color violeta y las no acido-alcohol resistentes de color azul. (en la imagen M. smegmatis) |
|
|

