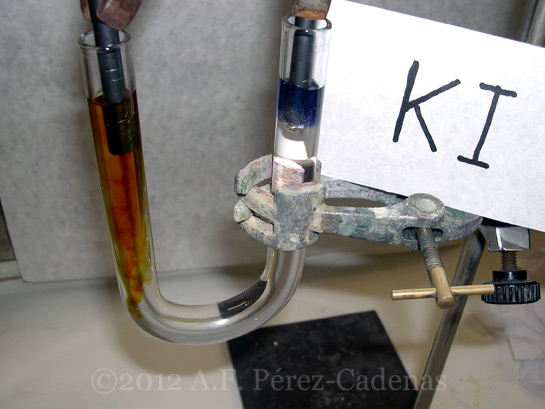telf: 958.243316
6. Conductividad de Disoluciones y Electrolisis
6.1 Conductividad de Disoluciones
6.2 Electrolisis
6.3 Formulario
6.1.1 Conductividad de Disoluciones - Introducción:
Para que una disolución sea conductora de la electricidad es necesario la presencia de iones en la misma. Así, aquellas sustancias que en disolución se disocian formando iones conducen electricidad y se denominan electrolitos; por el contrario las sustancias que no conducen la electricidad cuando están disueltas se denominan no electrolitos. Los no electrolitos son sustancias que en disolución no se disocian formando iones.
Los compuestos iónicos se caracterizan, entre otras cosas, por ser conductores de la electricidad cuando están disueltos o fundidos: así los iones que los forman, átomos o grupos atómicos con carga positiva ó negativa, tienen gran libertad para moverse y por eso pueden transportar la electricidad. Siempre que una disolución es conductora de la corriente eléctrica, es porque en ella existen iones. En ausencia de campo eléctrico los iones se mueven de forma caótica al azar, el resultado neto de dicho movimiento es el mismo que si se encontraran en reposo. Sin embargo, bajo la influencia de un campo eléctrico, el resultado es que la diferencia de potencial entre los dos electrodos produce un flujo de iones, es decir una conducción.
La conductividad eléctrica de un electrolito se puede definir como la capacidad del mismo para transmitir una corriente eléctrica. La conductividad dependerá en este caso de la cantidad de iones disueltos en el mismo, de la carga y movilidad de estos iones, y de la viscosidad del medio en el que se hallan disueltos.
6.1.2 Conductividad de disoluciones - Parte Experimental:
El dispositivo experimental consiste en un circuito simple compuesto por una fuente de corriente continua de 6 V y una bombilla. En el panel de control podemos distinguir la llave de encendido y apagado (on/off) y la bombilla 1. El circuito está abierto en sus extremos por dos pinzas donde fijaremos los electrodos de grafito.

A) Cogemos tres vasos de precipitados de 100 cm3 y colocamos en ellos las siguientes sustancias: agua destilada en uno (hasta la mitad de su capacidad), sacarosa (azúcar) en otro y NaCl (sal común) en otro; estos dos últimos, sólidos, hasta cubrir dos cm de altura. A continuación introducimos en uno de los vasos los dos electrodos, y encendemos la llave de corriente observando si se enciende la bombilla.
Repetiremos este procedimiento con los otros dos vasos restantes, con la precaución de limpiar bien los electrodos al pasar de un vaso a otro. Igualmente observemos y anotemos en nuestro cuaderno qué le ocurre a la bombilla en cada uno de los casos. La bombilla no debe de encenderse.
B) Ahora vamos a repetir el procedimiento descrito en el apartado anterior utilizando una disolución acuosa de sacarosa en un vaso, y una disolución acuosa de NaCl en otro. Cuando comprobemos la conductividad eléctrica de la disolución de sacarosa observaremos que la bombilla tampoco se enciende, debido a que la disolución de sacarosa no genera iones, no es un electrolito.

Sin embargo al realizar esta experiencia con la disolución acuosa de NaCl sí observaremos que se enciende la bombilla, ya que el NaCl es un compuesto iónico.

C) Finalmente ensayaremos de nuevo con un vaso de una disolución acuosa de ácido sulfúrico 1M, y compararemos el resultado obtenido con el correspondiente a otro vaso de una disolución acuosa de ácido acético de igual concentración.
Cuando comprobamos la conductividad de la disolución de ácido sulfúrico observaremos que la bombilla se enciende y brilla con intensidad.

Por otro lado, cuando comprobamos la conductividad de la disolución de ácido acético observaremos que la bombilla también se enciende, pero brilla notablemente con menor intensidad.

Para explicar este fenómeno hay que recordar que las disoluciones de electrolitos pueden clasificarse también como fuertes o débiles, en función de la capacidad de estas para disociarse y generar más o menos iones. El ácido sulfúrico es un ácido fuerte, y su disolución acuosa se comporta como un electrolito fuerte, sin embargo, el ácido acético es un ácido débil, y su disolución acuosa se comporta como un electrolito débil.
NOTA: No olvidar limpiar perfectamente los electrodos, enjuagándolos con agua y secándolos con papel de filtro, antes de cada experiencia.
6.2.1 Electrolisis - IntroducciÓn:
Al introducir en un electrolito (disuelto o fundido) dos electrodos conectados a un generador de corriente continua, los iones positivos se dirigen al electrodo conectado al polo negativo o cátodo, y los iones negativos al electrodo conectado al polo positivo o ánodo. La conducción eléctrica la realizan los iones, e irá siempre acompaña de sendos cambios químicos que tendrán lugar en la superficie de los electrodos. Al llegar a los electrodos los iones se descargan y se estabilizan dando nuevas sustancias mediante reacción química: esto es la electrolisis. Es un proceso relativamente inverso a lo que ocurre en una pila.
Si se miden las cantidades de sustancias depositadas o generadas en los electrodos, y se registran las intensidades de corriente y tiempos de reacción, se pueden comprobar y aplicar las leyes de Faraday. Hoy día la electrólisis se aplica a numerosas aplicaciones industriales como por ejemplo: la obtención de metales puros (Cu, Zn), el recubrimiento metálico de objetos (dorado, plateado, niquelado, cromado...), la síntesis electro-catalítica de compuestos químicos de alto valor añadido, etc.
6.2.2 Parte Experimental:
Vamos a utilizar el mismo dispositivo descrito para la práctica anterior, de conductividad de disoluciones, situando las pinzas que agarran a los electrodos dentro de un tubo en forma de U, el cual fijaremos a un pie como se muestra en la fotografía.
El electrodo fijado en la pinza negra es el cátodo o electrodo negativo. Por el contrario el electrodo fijado en la pinza roja es el ánodo o electrodo positivo. Cuando la bombilla 2 se encuentra encendida nos indica que la fuente de corriente está conectada. En el cátodo se producirán los procesos de reducción y en ánodo se producirán los procesos de oxidación.
A) Electrólisis de una disolución de nitrato potásico (KNO3)
Llenamos el tubo en U con una disolución de KNO3 al 5% y adicionamos a cada rama unas gotas de tintura de tornasol.
Introducimos los electrodos, conectamos la fuente de corriente y observamos qué sucede. Observaremos que alrededor del cátodo la disolución se colorea azul, mientras que en el ánodo aparece una coloración roja.
Esto se debe a que tanto el K+ como el NO3- son iones muy estables; la reducción del K+ y la oxidación del NO3- es muy difícil y por tanto es el agua el que sufre ambos procesos de oxidación y reducción, de la siguiente forma:
Cátodo: 2 H2O + 2e- → H2 + 2OH- (disolución básica, color azul)
Ánodo: 2 H2O → O2 + 4H+ + 4e- (disolución ácida, color rojo)
B) Electrólisis de una disolución de ioduro potásico (KI).
En este caso llenaremos el tubo en U con una disolución de KI al 8%.
Conectamos los electrodos a la fuente de corriente continua y dejamos transcurrir unos minutos, observando si aparece alguna sustancia perceptible a simple vista, es decir si tiene lugar algún cambio de color en el electrodo dónde tiene lugar la oxidación (ánodo) o en el que tiene lugar la reducción (cátodo).
Pasado un tiempo veremos que en el ánodo comienza a formarse una sustancia de color amarilla, ésta es yodo (I2). El I2 producido en el ánodo reacciona con el ión I- de la disolución para dar el complejo I3-.
Seguidamente añadiremos una gota de tintura de tornasol a la disolución próxima al cátodo y observaremos que en ésta, de nuevo, aparece una coloración azul; ya sabemos por qué.
Los procesos de oxidación reducción que se han producido son los siguientes:
Cátodo: 2 H2O + 2e- → H2 + 2OH- (color azul)
Ánodo: 2 I- → I2 + 2e- (color amarillo)(nótese que en este caso el cátodo (electrodo fijado a la pinza negra) se ha situado a la derecha del tubo en U)
Para finalizar éste apartado realizaremos unos ensayos con el yodo obtenido. En primer lugar con la ayuda de un cuenta gotas o de una pipeta extraeremos aproximadamente 2 cm3 de la disolución próxima al ánodo y lo introducimos en un tubo de ensayo.

Verteremos esta disolución en un tubo de ensayo que contenga alrededor de 1 cm3 de diclorormetano (CH2Cl2), el cual es inmiscible con el agua e incoloro, por lo que se formarán dos fases claramente diferenciadas. Tapando el tubo, y agitando vigorosamente durante unos segundos observaremos que la fase inferior, que es la que contiene al CH2Cl2, es ahora de color rosa.
Esto se debe a que parte del yodo ha sido extraído por la fase de CH2Cl2, como I2.
Finalmente y siguiendo el procedimiento indicado en el apartado anterior, añadiremos unas gotas de la disolución próxima al ánodo sobre un tubo de ensayo que contenga 5 cm3 de agua, y adicionaremos además unas gotas de una disolución de almidón.

Observaremos inmediatamente la formación de una coloración violeta.
Esta reacción es el resultado de la formación de cadenas de poli-yoduro a partir de la reacción del almidón con yodo. La amilasa, el componente del almidón de cadena lineal, forma hélices en cuyo interior se sitúan las moléculas de yodo, formando un complejo de inclusión de color azul-violeta.
C) Electrólisis de una disolución de nitrato cúprico (Cu(NO3)2)
Para esta experiencia llenaremos el tubo en U con una disolución de nitrato cúprico al 8%. Conectamos los electrodos a la fuente de corriente continua y dejamos transcurrir unos minutos, observando lo que sucede sobre la superficie del electrodo negativo, cátodo.
Durante el proceso electro-químico se depositará cobre en la superficie del cátodo (electrodo fijado a la pinza negra), siguiendo la siguiente semi-reacción:
Cu2+ + 2e- → Cu0
6.3. Formulario de Auto-evaluación
Aquí se encuentra el formulario de preguntas que debes rellenar y enviar por correo electrónico a tu profesor: