Tema 10: EFECTOS DEBIDOS A LAS SALES SOLUBLES
1.introducción
El deterioro inducido por soluciones acuosas salinas afecta a todos los materiales constructivos de edificios y monumentos, rocas, morteros, ladrillos, cerámicas, pinturas, vidrios, metales, etc. De hecho, las soluciones salinas son reconocidas como uno de los agentes de deterioro más agresivo, frecuente y efectivo en obras de interés histórico-artístico.
Todas las soluciones acuosas que circulan en superficie o por el interior de materiales pétreos y revestimientos presentan cantidades variables de iones en solución. Estos iones han sido extraidos por el agua al circular por:
· rocas naturales meteorizadas,
· suelos,
· rocas naturales de construcción,
· morteros de unión y revestimiento,
· ladrillos, etc,
aunque también pueden depositarse a partir de la composición de la atmósfera natural o polucionada y generarse a partir de la actividad metabólica de microorganismos.
Los iones se transportan en soluciones acuosas diluidas. Estas soluciones pueden introducirse en los materiales y circular a traves de sus poros y cavidades. La concentración de estas soluciones varia durante su circulación por los sistemas porosos de los materiales, debido a:
· su interacción química con los propios materiales, que suelen disolverse en mayor o menor medida, aumentando así la concentración de distintos iones en solución,
· la evaporación del agua, que aumenta la concentración de los iones,
· las variaciones de temperatura, que al descender induce un aumento de concentración, y viceversa, para la gran mayoría (no todas) de las especies químicas en solución,
· las variaciones de humedad relativa de aire, que al descender induce aumentos de concentración, y viceversa.
En cualquier momento que la solución alcance el punto de saturación para una sal concreta, por cualquiera de las causas anteriores, la sal precipitará en forma de eflorescencias (veladuras, pátinas o costras) o subeflorescencias.
Las sales solubles más comunes encontradas en eflorescencias y subeflorescencias de los edificios históricos son carbonatos, sulfatos, cloruros, nitratos y nitritos de sodio, potasio, calcio, magnésio y amonio, con grados variables de hidratación (Tabla 2). Entre estas sales, algunas de las más comunes son calcita (CaCO3), yeso (CaSO4·2H2O), kieserita (MgSO4·H2O), epsomita (MgSO4·7H2O), halita (ClNa) y nitratita (NaNO3). Adicionalmente los oxalatos de Ca (whewellita y weddellita, Tabla 1) se encuentran en bastantes edificios. Estas sales se se han interpretado clásicamente como el resultado de la interacción de tratamientos superficiales antiguos (ceras y aceites naturales) con el sustrato pétreo, aunque existen bastantes evidencias de que también resultan de la actividad orgánica de microorganismos, particularmente líquenes (Del Monte, 1990). Por otra parte, los sulfatos hidratados de Ca y Al, como ettringita (Ca6Al2(SO4)3(OH)12·26H2O), y de Si, como thaumasita (Ca3Si(CO3)(SO4)(OH)6·12H2O), se encuentra sobre todo como producto de degradación de morteros de cemento por ataque de soluciones sulfatadas. No obstante, estas sales pueden incidir en el ataque sobre las rocas y morteros de cal aérea o yeso si los muros han sido reintegrados con este tipo de aglomerantes.
Tabla 1.
Sales solubles presentes como eflorescencias y subeflorescencias
en edificios (compilado de Winkler, 1973, y Arnold y Zehnder, 1990).
Carbonatos Sulfatos
Calcita CaCO3 Yeso CaSO4·2H2O
Dolomita CaMg(CO3)2 Basanita CaSO4·0.5H2O
Magnesita MgCO3 Epsomita MgSO4·7H2O
Nesquehonita MgCO3·3H2O Hexahidrita MgSO4·6H2O
Lansfordita MgCO3·5H2O Kieserita MgSO4·H2O
Hidromagnesita Mg5[OH(CO3)2]2·4H2O Dodecahidrita MgSO4·12H2O
Heptahidrita Na2CO3·7H2O Darapskita Na3(SO4)(NO3)·H2O
Natrón Na2CO3·10H2O Miralbita Na2SO4·10H2O
Thermonatrita Na2CO3·H2O Thenardita Na2SO4
Nahcolita NaHCO3 Arcanita K2SO4
Trona Na3H(CO3)3·2H2O Bloedita Na2Mg(SO4)2·4H2O
Kalcinita KHCO3 Picromerita K2Mg(SO4)2·6H2O
Boussingaultita (NH4)2Mg(SO4)2·6H2O
Cloruros Syngenita K2Ca(SO4)2·H2O
Bischofita MgCl2·6H2O Görgeyita K2Ca5(SO4)6·H2O
Antarcticita CaCl2·6H2O Aphthitalita K3Na(SO4)2
Tachyhidrita CaMg2Cl6·12H2O Ettringita Ca6Al2(SO4)3(OH)12·26H2O
Halita NaCl Thaumasita Ca3Si(CO3)(SO4)(OH)6·12H2O
Silvita KCl
Oxalatos
Nitratos Whewellita Ca(C2O4)·H2O
Nitrocalcita Ca(NO3)2·4H2O Weddellita Ca(C2O4)·2H2O
Nitromagnesita Mg(NO3)2·6H2O
Nitratita NaNO3
Nitro (salitre) KNO3
Nitro amónico NH4NO3
Cuando las sales cristalizan en el exterior de los materiales (eflorescencias), no suelen producirse daños mayores excepto por lo que respecta a la estética del objeto dañado. En el caso de las pinturas murales, no obstante, las eflorescencias inducen trasformaciones fisicoquímicas de las capas pictóricas y sus sustratos, lo que suele implicar modificaciones cromáticas debidas sobre todo a la modificación de la naturaleza de los pigmentos. Por ejemplo, en ambientes húmedos, el blanco de plomo (2PbCO3·Pb(OH)2) puede transformarse en óxido de Pb (PbO2), de color marrón, y la azurita (2CuCO3·Cu(OH)2) de color azul puede transformarse en malaquita (CuCO3·Cu(OH)2), de color verde. Estos y otros cambios cromáticos en los estratos pictóricos son acelerados por las eflorescencias, incluso en ambientes relativamente secos, ya que las sales solubles constitutivas de las mismas son muy higroscópicas, lo que implica el mantenimiento de micro-ambientes húmedos en contacto con las capas pictóricas (Figura 1).
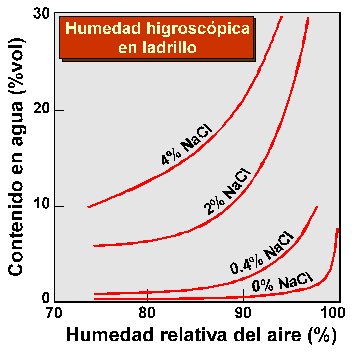
Figura 1.Humedad higroscópica sobre ladrillo en función de la humedad relativa del aire y de la cantidad de NaCl (halita) en la superficie del mismo (tomado de Winkler, 1973).
Por el contrario, la cristalización de sales en el interior de los materiales (subeflorescencias) induce un fuerte deterioro mecánico debido al desarrollo de esfuerzos por:
· cristalización a partir de una solución,
· expansión por hidratación, y
· expansión térmica diferencial,
de sales acumuladas en un medio confinado o parcialmente confinado. Estos esfuerzos se aplican sobre las paredes de los poros y cavidades que alojan las sales, dando lugar a una perdida de cohesión, generalmente relacionada con la fatiga de los materiales. El efecto es en algunos aspectos similar al del hielo, aunque el proceso de cristalización a partir de una solución es bastante distinto del de solidificación de un líquido.
Aunque las subeflorescencias son muy importantes en los procesos de deterioro de los materiales pétreos, la observación de eflorescencias superficiales es de extrema importancia ya que no sólo indica la presencia de soluciones salinas dañinas en el interior del material, sino que ofrece una idea del alcanze de la migración de agua en los sistemas porosos, esto es:
· del nivel de ascenso capilar o
· de los canales de infiltración del agua de lluvia.
A continuación introduciremos los procesos de deterioro generados por las sales solubles, particularizando en los relacionados con la formación de subeflorescencias: cristalización e hidratación de sales, excluyendo la expansión térmica diferencial que ha sido considerada en el Capítulo 7. No obstante, antes es interesante considerar brevemente algunos aspectos relacionados con la infiltración del agua.
2.Infiltracion de Agua
Las fuentes más importantes de las soluciones salinas en los edificios son dos:
· el agua del subsuelo, y
· el agua de lluvia.
La primera de ellas suele infiltrarse por capilaridad, mientras que la segunda se infiltra simplemente por gravedad al encontrar canales propicios (Figura 2). Adicionalmente, una fuente importante de agua en ambientes muy húmedos es el agua de condensación (i.e., niebla), que se adsorbe sobre los muros. Este tipo de agua puede mantener húmedas las superficies de muros y revestimientos durante bastante tiempo si las condiciones climáticas son propicias. Sin embargo, su infiltración hacia el interior de muros y revestimientos es cuantitativamente menor, ya que tiende a evaporarse al descender la humedad relativa de aire en períodos diarios. No obstante, de ser efectiva su infiltración sería esencialmente por capilaridad.
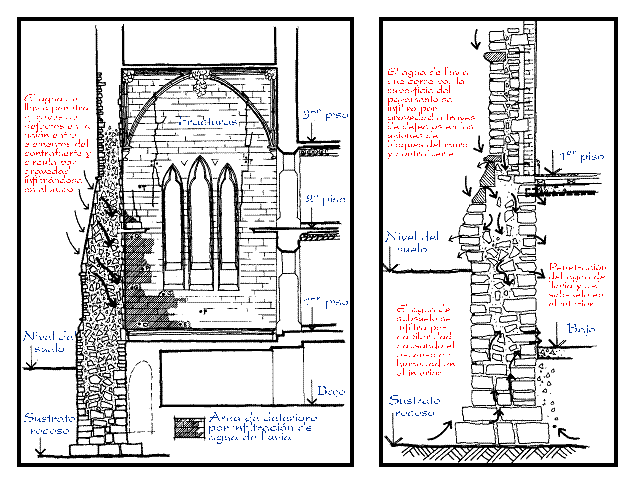
Figura 2. Esquema de circulación del agua de lluvia y del subsuelo a través de muros de edificios. Ejemplos tomados del Parlamento de Ottawa (1889-1867), según Blades y Stewart (en Ashurst y Dimes, 1990).
2.1.Infiltración de Agua por Capilaridad
El fenómeno de la capilaridad, cuyo resultado es el ascenso (o descenso) de un líquido en el interior de un tubo fino de un material sólido cuando éste es sumergido en el líquido, es debido a la existencia de fuerzas en la superficie de las sustancias sólida (e.g., piedra o mortero), líquida (e.g., agua) y gaseosa (e.g., aire) en contacto. Estas fuerzas se denominan de tensión superficial.
La conjunción de estas fuerzas en sistemas solido-líquido-gas hace que las gotas de un líquido depositadas sobre la superficie de un material sólido presenten ángulos de contacto sólido-líquido variados, en función de la naturaleza de los sólidos, líquidos y gases en contacto. Así, los líquidos “mojan” a los sólidos cuando el ángulo de contacto está comprendido entre 0 y 90º, en cuyo caso el líquido asciende por el capilar. Si por el contrario la conjuncion de fuerzas de tensión superficial condicionan que el ángulo de contacto sólido-líquido esté comprendido entre 90 y 180º, el líquido “no moja” al material y desciende por el capilar. Estas relaciones se ilustran en las Figuras 3 y 4.
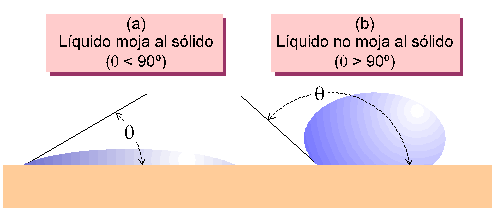
Figura 3. Variación en el ángulo de contacto sólido-líquido. En (a) el líquído (e.g., agua) moja al sólido (e.g., mortero), y q < 90º, mientras que en (b) el líquido (e.g., mercurio) no moja al sólido y q > 90º.
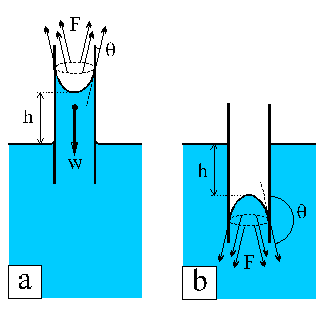
Figura 4. Fuerzas resultantes (F) de la conjuncion de las tensiones superficiales en un sistema sólido-líquido-gas en un tubo capilar (w es el peso de la columna de agua para el caso a). El líquido se eleva una altura h si (a) q < 90º, y desciende si (b) q > 90º.
La altura a la que asciende (o desciende) un líquido en un capilar no es sólo función del ángulo de contacto, sino que depende también del radio del capilar. La ecuación que describe la altura alcanzada por un líquido en un capilar es:
![]()
![]()
donde h es la altura
(cm), positiva si asciende o negativa si desciende, SLV es la tensión superficial líquido-vapor (72.8 dinas/cm para el caso de agua-aire, a
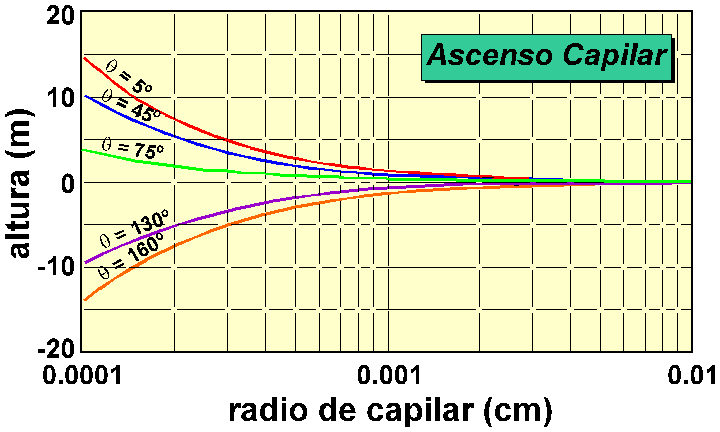
Figura 5 Curvas altura-radio de capilar calculadas para el sistema agua-aire. La curva de q=75º corresponde al ascenso capilar del agua en contacto con una caliza micrítica de Sierra Elvira. Nótese que valores de altura negativos se obtienen para q > 90º, lo que implica que el agua descenderá en el capilar.
El ángulo de contacto entre el agua y las
distintas fases minerales presentes en muros de piedra, ladrillo, y
revestimientos de mortero es variable. No obstante, en todos los casos el agua
moja a estas sustancias dado su naturaleza polar (i.e., enlaces esencialmente
iónicos). Por ejemplo, el ángulo de contacto entre calcita y agua, medido en
una probeta de caliza de Sierra Elvira es de 75.75º(±4.33) (Durán-Suárez,
1995). Tomando como valor significativo 75º, la altura alcanzada por el agua
para radios de poro de
En los cálculos anteriores se ha supuesto que las soluciones acuosas pueden ascender por capilaridad a partir de un reservorio infinito. Sin embargo, en la realidad el asecenso del agua depende de la tasa de aporte de agua del subsuelo y de la tasa de evaporación en una vez localizada en el muro. Las variaciones climáticas diarias y estacionales controlan estas dos tasas, de forma que el comportamiento hídrico del sistema muro-solución acuosa es bastante complejo a escala de tiempo mayores del dia y del año. Los casos más problemáticos desde el punto de vista conservativo de edificios y pinturas murales son, lógicamente, aquellos en los que el reservorio puede considerarse infinito. Estos casos se dan cuando el subsuelo se mantiene húmedo, ya sea por las carácterísticas del clima local (clima lluvioso) como por la localización del edificio (e.g., cercano a un río, acequias, conducciones de aguas residuales, etc). En estas situaciones, el ascenso del agua está controlado por la tasa de evaporación, y el sistema tiende a un estado estacionario. Esto es, el agua asciende contínuamente hasta una altura constante controlada por la tasa de evaporación. Para alcanzar este estado estacionario se necesita que la tasa de evaporación sea constante durante un tiempo suficiente, lo cual no se corresponde con la realidad. En consecuencia, la altura del agua un muro que sufra infiltración capilar variará a escala diaría y estacional, así como entre distintas zonas de un mismo edificio dependiendo de las carácterísticas microclimáticas de las mismas (e.g., interiores vs. exteriores, zonas orientadas al norte vs. al sur, etc).
Cuando el subsuelo es deficiente en agua, como en climas secos y calurosos, el ascenso está controlado por la tasa de aporte. La deficiencia de agua hace que los daños ocurridos sobre muros y revestimientos sean menores en esta situación. Si la tasa de evaporación es, además, relativamente fuerte, como corresponde a climas secos y calurosos, la altura del ascenso de las soluciones acuosas es escasa, limitándose los deterioros a las zonas próximas al zócalo.

Figura
6. Esquema de ascenso capilar de agua del
subsuelo en muros con decoración mural de
2.2.Infiltración de Agua por Gravedad
El agua de lluvia suele infiltrarse por gravedad (Figura 2). Esta circulación está condicionada a la existencia de canales preferentes infiltración, que generalmente se relacionan con discontinuidades mayores existentes en los edificios. Estas las constituyen las uniones entre los elementos constitutivos de los edificios, que suelen estar ocupadas por morteros de unión. En el caso ideal de un edificio bien concebido, estas uniones estan bien protegidas del agua, aunque la casuística general de los edificios históricos es que los defectos en los sistemas de evacuación de aguas (tejados, canalones, gárgolas, cornisas, etc) sean de una magnitud considerable. Más aún, es relativamente normal encontrar deterioros estructurales debidos a problemas de asentamiento en el terreno, terremotos, cargas no compensadas, etc, que son canales de circulación preferente. En todos estos casos, la infiltración de agua por gravedad está garantizada (Figuras 2, 7 y 8).

Figura
7. Infiltración de agua de lluvia por gravedad en
el muro con decoración mural de la fachada

Figura 8. Infiltración de agua de lluvia por gravedad en un muro con decoración mural de una casa de la plaza de Santa Ana (Granada). Los defectos en la canalización del agua (canalón metálico) han permitido la escorrentía del agua sobre en muro, con el consiguiente deterioro de la decoración mural.
3.recipitacion de Sales y Fraccionacion de Soluciones Salinas
3.1.Precipitación de Sales
La circulación de agua por capilaridad o gravedad en los edificios transporta igualmente los iones en solución. Este sistema salino es inicialmente homogéneo, esto es, consta de una única fase, la solución acuosa. No obstante, las especies químicas (aniones y cationes) en solución son muy variadas, por lo que pueden precipitar una gran variedad de sales. La precipitación de una sal en un sistema multicomponente se produce cuando se alcanza una determinada concentración, denominada de saturación, para las especies químicas que forman la sal. La reacción que gobierna la disolución/precipitación de la sal puede simplificarse como sigue:
nCAsol Û mC+aq + pA-aq
donde C+aq y A-aq son la especies catiónica y aniónica, respectivamente, en solución acuosa y CAsol es la sal sólida, y n, m y p son los moles de cada especie que intervienen en la reacción. Cuando la solución acuosa está saturada en la sal CA, las concentraciones de las especies C+aq y A-aq en solución no son cualesquiera, sino que vienen descritas por la constante de equilibrio, K:
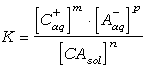
donde los corchetes indican las concetraciones[1] de las distintas sustancias. Si la sal es pura (i.e., no es una solución sólida), la concentración de la especie CAsol es igual a 1, por lo que la constante de equilibrio queda:
![]()
Este producto también
se denomina producto de solubilidad. El valor de la constante de equilibrio
depende de un gran número de variables, tales como la temperatura, presión,
humedad relativa, pH, concentración de otras
especies, etc.

Figura 9. Solublidad de algunas sales en agua en función de la temperatura a 1 atmósfera de presión (según Babor e Ibarz, 1979). Notése que la solubilidad asciende con la temperatura en la mayoría de los casos, y que las transiciones de fase debidas a estados de hidratación variados para determinadas sales están marcados por inflexiones en las curvas de equilibrio.
La precipitación de una sal determinada a partir de una solución acuosa, bajo condiciones ambientales dadas, se producirá cuando la concentración de las especies en solución constitutivas de la sal sea tal que el producto solubilidad sea igual o superior a la constante de equilibrio. Cuando ambas funciones son iguales, la condición es de equilibrio y la solución se denomina saturada, mientras que cuando el producto de solubilidad es mayor que la constante de equilibrio, la condición es de desequilibrio y la solución se denomina sobresaturada.
Por constricciones de la cinética de reacción, las sales precipitan cuando se dan desviaciones del equilibrio, esto es, cuando la solución está sobresaturada. Estas últimas soluciones presentan cantidades mayores de sal en solución de las que puede disolver (esto es, de las que predice el equilibrio químico), por lo que son inestables y tienden a precipìtar una cantidad de sal que haga que la concentración descienda, de forma que el producto de solubilidad sea igual a la constante de equilibrio (esto es, que haga retornar a la solución a la condición de equilibrio). El grado de sobresaturación a partir del que precipitan las sales depende del tipo de sal y de las condiciones ambientales, aunque suele ser relativamente pequeño de forma que el producto de solubilidad y la constante de equilibrio sean muy similares. Obviamente, cuanto mayor sea la sobresaturación, mayor será la cantidad de sal precipitada.
En las soluciones que circulan por los
edificios, las condiciones de sobresaturación se dan cuando se produce
evaporación del agua o cuando se dan cambios de temperatura, generalmente
descensos, ya que la solubilidad de las sales aumenta generalmente con la
temperatura (Figura 9). Estas relaciones pueden apreciarse en
· Descenso de la temperatura. Si el cambio de temperatura infinitamente rápido (instantáneo), la concentración de la solución se mantiene constante y se situa por encima de la curva de equilibrio, precipitando bruscamente la sal cuando se alcanze un determinado grado de sobresaturación (punto B). La cantidad de sal precipitada dependerá de la magnitud de la sobresaturación (recta B-B’). Si el cambio de temperatura es infinitamente lento, la solución alcanza su punto de saturación (punto A'). En este punto se producirá una ínfima precipitación de sal, que hará descender infinitesimalmente la concentración de la solución, que coincidirá con la concentración de equilibrio descrita por la curva de saturación. El descenso continuado de temperatura hará que este proceso se repita de forma que la sal va precipitando en equilibrio, y la concentración de la solución evoluciona a lo largo de la curva A'-B’. La cantidad de sal precipitada será idéntica a la correspondiente al caso de sobresaturación descrito antes. Cambios instantáneos de temperatura no son posibles (la transmisión del calor por conducción, convección y advección es relativamente lenta). No obstante, cambios bruscos de la temperatura pueden alcanzarse fácilmente en ambientes superficiales, tales como en ciclos de temperatura diarios sobre todo en zonas semiáridas y áridas, lo cual permite la sobresaturación. En general, el cambio de temperaturas no será lo suficientemente rápido como para producir una trayectoria de sobresaturación como la de la linea A-B-B’, sino que será intermedia entre ésta y la de cristalización en equilibrio A-A'-B’.
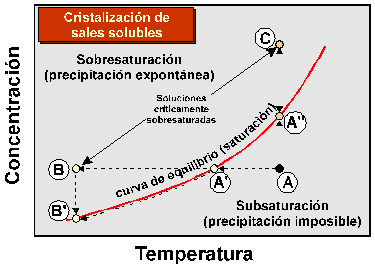
Figura 10. Diagrama esquemático temperatura-concentración de soluto, con indicación de la curva de equilibrio (saturación), campos de sobresaturación y subsaturación, y puntos de sobresaturación crítica y saturación a partir de los que se produce precipitación.
· Incremento de la concentración. Este proceso puede darse por evaporación del agua. Si el incremento de concentración es infinitamente rápido, la temperatura se mantiene constante y se situa por encima de la curva de equilibrio, precipitando bruscamente la sal cuando se alcanze un determinado grado de sobresaturación (punto C). La cantidad de sal precipitada dependerá de la magnitud de la sobresaturación (recta C-A’’). Si el incremento de concentración es infinitamente lento, la solución alcanza su punto de saturación (punto A’’). En este punto se producirá una ínfima precipitación de sal, que hará que la concentración de la solución permanezca en el punto de equilibrio A’’. La evaporación continuada hará que este proceso se repita de forma que la sal va precipitando en equilibrio, y la concentración de la solución se mantiene en el punto A’’. La cantidad de sal precipitada será idéntica a la correspondiente al caso de sobresaturación (recta C-C’). Cambios bruscos en la concentración que produzcan sobresaturación pueden darse por rápida evaporación del agua contenida en poros y capilares superficiales de las rocas porosas y morteros, particularmente cuando el sol incide directamente sobre los mismos. No obstante, la evaporación no será lo suficientemente rápida como para producir una trayectoria de sobresaturación como la de la linea A-C-C’, sino que será intermedia entre ésta y la de cristalización en equilibrio A-A’’.
· Una combinación de ambos procesos. Esta situación es poco probable, dado que el descenso de temperatura no favorecerá la evaporación del agua para incrementar la concentración de la solución.
Otra de las variables que inciden fuertemente en la precipitación de sales es la humedad relativa del aire. En las condiciones de los sistemas porosos donde cristalizan las sales, la humedad relativa del aire que circula junto con las soluciones acuosas puede controlar de forma efectiva la precipitación de determinadas sales ya que cantidades moderadas de sal se encuentran en contacto con elevadas cantidades de aire húmedo, particularmente si este último circula con relativa facilidad. En estos casos, y bajo condiciones ambientales determinadas (i.e., temperatura fija, etc), la humedad relativa del aire en equilibrio con la solución saturada (HReq) viene determinada por la ecuación:
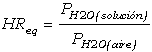
donde PH2O(solución)
es la presión de vapor del agua en la solución salina saturada, y PH2O(aire)
es la presión de vapor del agua en el aire saturado. Las humedades relativas en
equilibrio con soluciones saturadas para distintas sales se presentan en
HR
£ HReq
Bajo las condiciones de sistemas porosos, la
humedad relativa del ambiente determina si una sal precipita, y así deteriora
una roca, mortero o capa pictórica, o se disuelve. Siempre que
Como puede deducirse, estos ciclos son comunes
a escala diaria por causas climáticas, por lo que la protección de los objetos
(e.g., pinturas murales) expuestas al exterior
es prácticamente imposible. En los interiores, las condiciones
ambientales pueden parecer más estables, al quedar el aire relativamente
aislado. Sin embargo, cambios en las condiciones de HR del aire de interiores
pueden ser inducidos por causas que pueden evitarse con facilidad. Así, el encendido
de determinado tipo de lámparas hace aumentar rápidamente la
temperatura del aire y, en consecuencia, descender descender
rápidamente
Tabla 2. Humedades
relativas del aire en equilibrio con soluciones saturadas de distintas sales
(tomado de Arnold y Zehnder,
1990). Nótese las sales hidratadas son particularmente sensibles a las
variaciones en la humedad relativa.
Sal
Antarcticita CaCl2·6H2O 41.0 37.7 33.7 30.8 28.6 22.4
Bischofita MgCl2·6H2O 33.7 33.6 33.5 33.3 33.1 32.8 32.4
Nitrocalcita Ca(NO3)2·4H2O 59.0 59.6 56.5 54.0 53.6 50.5 46.8
Nitromagnesita Mg(NO3)2·6H2O 60.4 58.9 57.4 55.9 54.4 52.9 51.4
Nitro amónico NH4NO3 61.8
Nitratita NaNO3 78.6 77.5 76.5 75.4 74.3 73.1
Halita NaCl 75.5 75.7 75.7 75.6 75.5 75.3 75.1
Thenardita Na2SO4 82.0 82.2 84.3
Silvita KCl 88.6 87.7 86.8 85.9 85.1 84.3 83.6
Epsomita MgSO4·7H2O 86.9 90.1 88.3 88.0
Natrón Na2CO3·10H2O 96.5 97.9 88.2 83.2
Miralbita Na2SO4·10H2O 95.2 93.6 91.4 87.9
Nitro (salitre) KNO3 96.3 96.3 96.0 95.4 94.6 93.6 92.3
3.2.Transformaciones de fase por Hidratación-Deshidratación de Sales
Como hemos visto, las variaciones de temperatura y humedad relativa del aire en contacto con las sales precipitadas inducen procesos de disolución y precipitación de sales. Sin embargo, estas procesos están frecuentemente acompañados de procesos de hidratación/deshidratación en muchas sales comunes de eflorescencias y subeflorescencias, ya que las variaciones de temperatura y humedad relativa inducen transiciones de fase.
En general, el aumento de temperatura induce deshidratación,
de forma que las sales pierden moléculas de agua estructurales. Las
transiciones a estados de hidratación distintos se marcan por inflexiones en
las curvas de equilibrio concentración-temperatura de
CaSO4·0.5H2O (basanita) + 1.5 H2O Û CaSO4·2H2O (yeso)
Dado que la basanita es la fase menos hidratada, su campo de estabilidad se localiza a mayores temperaturas y menores humedades relativas. Este mismo tipo de relaciones aplica a todas las sales hidratadas encontradas en eflorescencias y subeflorescencias en muros y revestimientos.
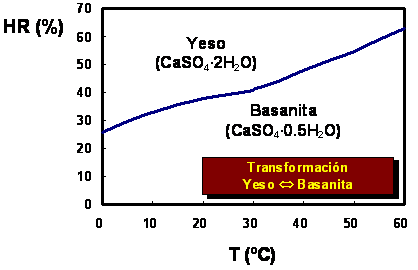
Figura 11. Diagrama temperatura-humedad relativa para la transformación basanita Û yeso para 1 atmósfera de presión (Datos de Winkler y Wilhelm, 1970).
El ajuste de las sales a las nuevas condiciones de T y HR se produce mediante el paso de una fase mineral a otra con un contenido de agua estructural distinto. Esto conlleva cambios de volumen en la nueva fase mineral, y el potencial desarrollo de presiones sobre las paredes de los poros como veremos más adelante. En general, el proceso de hidratación implica únicamente la incorporación de agua a la estructura cristalina, manteniéndose la composición iónica original del mineral anhidro. El proceso es bastante complicado, implicando el paso de una fase a otra no a través del estado sólido, sino a través de reacciones de disolución y precipitación. Al cambiar las condiciones ambientales, la solubilidad del mineral inestable aumenta, lo que supone que comienza a disolverse; por otra parte, desciende la solubilidad del mineral estable, que rápidamente llega a la saturación y precipita.
3.3.Fraccionación de Soluciones Salinas
Cuando una solución salina que circula por el sistema poroso de un muro o revestimiento comienza a precipitar, lo hace a un determinado nivel dentro de la trayectoria seguida. La posición exacta de precipitación coincide, lógicamente, con el punto en que la solución deviene en mayor o menor medida sobresaturada, por lo que este punto dependerá de:
· las condiciones ambientales del sistema muro-solución-aire, y
· la naturaleza de los iones en solución.
Este último punto es importante, ya que no todas las sales disueltas en un solvente como el agua alcanzan la sobresaturación bajo las mismas condiciones ambientales (ver Figura 9 para el caso de la temperatura). Las sales precipitarán a partir de una solución multicomponente en una secuencia controlada por las diferentes solubilidades de las sales. En función de las condiciones ambientales, puede por tanto predecirse en que puntos de la trayectoria seguida por la solución cristalizará cada sal.
La precipitación episódica o secuencial de sales debida a sus distintas solubilidades es un proceso común en la naturaleza. El proceso se denomina cristalización fraccionada, y conlleva un cambio de composición de la solución salina a medida que cada sal precipita. Este cambio de composición de la líquida se denomina fraccionación. El resultado de estos procesos es:
· una distribución areal de sales característica, sobre y dentro de los muros y revestimientos, siempre y cuando la solución se mueva, y
· una deposición “estratigráfica de sales”, en un mismo punto.
Para ejemplificar estos aspectos, utilizaremos el caso de infiltración capilar, aunque los mismos argumentos y conclusiones pueden sacarse para la infiltración de agua de lluvia.
3.3.1.Distribución areal de sales: Zonación del Deterioro de Muros y Revestimientos
Los muros, con revestimientos o no, afectados
por infiltración capilar suelen mostrar una zonación en cuanto al
deterioro observable externamente. Un esquema de esta zonación se presenta en
Aunque puede considerarse bastante general, este esquema de zonación no pretende cubrir lógicamente toda la casuística. Es posible que en muros y revestimientos muy deteriorados la zona A presente un estado ruinoso con la zona B, y la zona C puede presentar grados muy variables de deterioro.
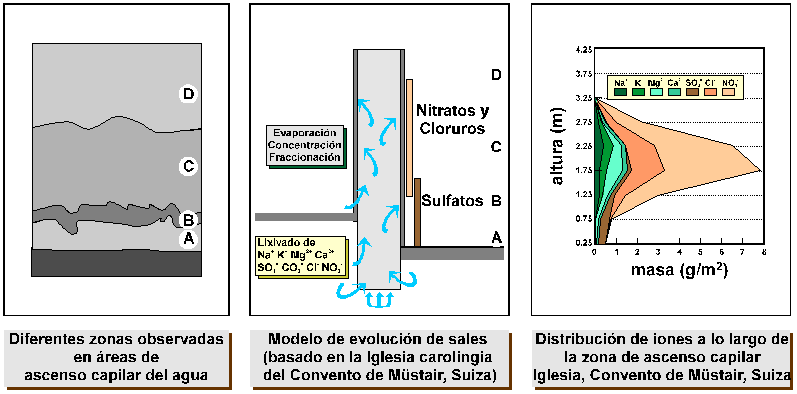
Figura 12. Zonación del deterioro y cristalización de sales debidos al ascenso capilar y fraccionación de soluciones salinas en muros y revestimientos.
La distribución de sales a lo largo de la
zonación (Figura 12) es el resultado de la fraccionación
de la solución. Durante su ascenso, la solución comienza a evaporarse desde el
primer momento que el aire está en contacto con el muro. No obstante, en la
zona A la tasa de evaporación no es suficiente para concentrar de forma
efectiva la solución debido al aporte de la misma desde el immediato
subsuelo. A algo más de altura, en la zona B, la tasa de evaporación supera
suficientemente a la tasa de aporte de la solución, por lo que la concentración
aumenta hasta saturarse en las sales menos solubles (sulfatos, y algunos
carbonatos y nitratos). Se forman de esta manera abundantes eflorescencias y subeflorescencias, con el consiguiente deterioro para los
materiales. Una vez precipitadas las sales menos solubles, quedan en solución
aquellas cuya solubilidad es tal que se necesitan tasas de evaporación muy
fuertes para concentrarlas de forma efectiva. Si esto no ocurre, la solución
migra transportando los iones y la zona C queda simplemente húmeda por el
ascenso capilar, pero no precipitan sales. Si la evaporación es muy intensa, la
migración de los iones en solución puede detenerse en la zona C si se alcanzan
las condiciones de saturación, precipitando sales como cloruros y nitratos en
esta zona. No obstante, las cantidades de sal precipitadas en forma de
eflorescencias o subeflorescencias serán
relativamente menores debido a la alta solubilidad de estas sales y su caracter fuertemente higroscópico. Así, bajo condiciones de
humedad relativa elevadas las posibles sales precipitadas tenderán a adsorber
agua de la atmósfera, condensándola y favoreciendo su redisolución. Sólo en
caso de infiltración de soluciones muy salinas y de tasas de evaporación muy
fuertes en ambientes secos se encontrará en esta zona C abundancia de sales y
fuerte deterioro. Este parece ser el caso de
Esta tipo de secuencias se forman no solo por ascenso capilar del agua. También pueden darse en una corriente de solución salina que discurre por la superficie de un objeto (e.g., agua de lluvia). En todos los casos, a mayor solubilidad de la sal mayor será la distancia a la que precipita respecto de la fuente de la solución.
3.3.2.Deposición “estratigráfica” de sales: Eflorescencias y Subeflorescencias
La localización exacta de una sal respecto de la superficie exterior depende del mecanismo de saturación de la solución. En el caso de deberse a evaporación, el proceso está controlado por dos procesos difusivos que actuan simultáneamente. Por un lado, la tasa de evaporación, o de difusión de vapor de agua a través del material ya seco hacia el exterior, y por otro la tasa de aporte de solución a través de la red porosa bañada hacia el frente de evaporación. Si la velocidad de difusión del vapor es menor que la de migración de la solución, esta última podrá llegar a la superficie externa donde se evaporará y cristalizarán las sales. Se forman en este caso las eflorescencias. Si, por el contrario, la tasa de migración de solución es menor que la tasa de difusión del vapor de agua, el equilibrio se alcanzará a una cierta distancia de la superficie, produciéndose en este caso subeflorescencias. Obviamente, las tasas de evaporación, o de difusión del vapor de agua a través del material ya seco hacia el exterior, dependen de la humedad relativa del aire exterior. Bajo condiciones de humedad relativa más bajas, las tasas de difusión del vapor de agua son mayores, por lo que se producirá una mayor precipitación de sales en forma de subeflorescencias.
Lógicamente, variaciones en las condiciones ambientales hacen que una determinada sal pueda cristalizar como eflorescencia o como subeflorescencia en distintos momentos (a escala diurna y estacional), lo cual general secuencias “estratigráficas” formadas por sales de la misma naturaleza. Además, si la solución es multicomponente puede darse el caso que determinadas sales cristalizen como eflorescencias y otras como subeflorescencias a una misma altura del muro y al mismo tiempo. Este proceso es semejante al proceso de fraccionación descrito anteriormente, aunque la escala es mucho menor. Así, si la tasa de difusión del vapor es suficientemente lenta como para permitir el acceso de la solución a la superficie exterior, la evaporación tiene lugar sobre esta última, de forma que incluso una sal moderada a fuertemente soluble en agua puede precipitar como eflorescencia. Sin embargo, la evaporación tambien hará concentrar la solución localizada immediatamente por debajo de la superficie en cierto grado, de manera que puede alcanzarse el punto de saturación para una sal menos soluble que la cristalizada en el exterior, formándose una subeflorescencia. El resultado es una secuencia “estratrigráfica” formada por sales de distinta naturaleza.
Por otro lado, si el mecanismo de saturación se debe al descenso de la temperatura, entonces lo más probable es que se formen subeflorescencias, dado que la solución contenida en el sistema poroso no se mueve, y las sales cristalizan en el interior del material donde la temperatura desciende lo suficiente para saturar la solución.
Estas generalizaciones son sólo válidas para medios homogéneos. En medios heterogéneos, como los constituidos por un sistema muro-revestimiento de mortero-película pictórica, la situación es más complicada. Asi, a pesar de que las condiciones ambientales sean propicias para la formación de eflorescencias, las sales pueden cristalizar en la superficie de contacto entre el muro y el mortero, o entre el mortero y la capa pictórica. Esto es debido a que la nucleación y crecimiento de las fases sólidas no depende únicamente de la difusión de material, sino de efectos energéticos de superficie. Así, no es raro encontrar cristales que crecen preferentemente sobre deteminados materiales, como por ejemplo, cristales orientados de micas.
No obstante, el deterioro de rocas y pinturas murales de muros no se ve críticamente afectado por los mecanismos concretos de nucleación y crecimiento. Una vez que la sal se encuentra en el interior del material, los procesos de deterioro ocurren de forma similar a como ocurrirían en medios homogéneos.
3.4.Morfología de los Cristales de Sales
Los hábitos más comunes de las sales encontradas en eflorescencias y subeflorescencias de muros y revestimientos son muy variados, desde ecuantes a prismáticos y aciculares, a menudo similares a pelos que difieren enormemente de las formas cristalinas de equilibrio de las sales y se denominan whiskers (barbas, en inglés). Este último tipo de forma se encuentra sobre todo en eflorescencias muy poco compactas, generalmente similares a una pelusa muy debil.
Una determinada sal puede coexistir en forma de whiskers y en formas cristalográficas (idiomorfas) características de la sal en una misma masa salina (Figura 13). En general, esta coexistencia se debe a estadios de cristalización distintos, controlados por condiciones ambientales distintas (T, HR, grado de sobresaturación, humedad del sustrato, impurezas de la solución, velocidad de la solución,...).

Figura
13. Morfología de sales en eflorescencias sobre
pinturas murales interiores de
Quizás, la variable que más afecta a la
morfología de las sales sea la humedad del sustrato. Esta variable está,
lógicamente, muy relacionada con la temperatura y la humedad relativa del
ambiente. En
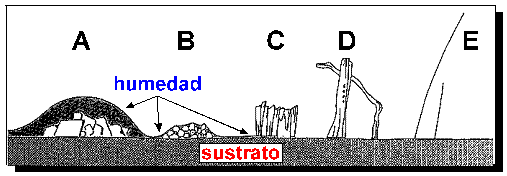
Figura 14. Relaciones entre la morfología cristalina de sales precipitadas y la humedad del sustrato y paredes de poros. (A) Cristales grandes con formas características de la sal crecen inmersos en la película de solución del sustrato húmedo. (B) Cristales granulares más pequeños forman una costra compacta, escasamente cubierta por la película de solución. (C) Costra formada por cristales columnares y fibrosos en contacto con el aire crecidos a partir de la superficie del sustrato mojada por una fina película de solución. (D) Cristales columnares, aciculares y whiskers gruesos en contacto con el aire crecen de forma aislada a partir de la superficie mojada por delgadas gotas aisladas de solución. (E) Cristales aciculares muy delgados y alargados (whiskers) crecen a partir de una superficie casi seca, que recibe la solución de forma puntual a través del sustrato. (Según Arnold y Zehnder, 1990).
Estas variaciones morfológicas son típicas en distintos niveles de eflorescencias en muros y revestimientos, encontrándose costras más compactas (formas ecuantes) en los niveles inferiores más húmedos y pelusa (whiskers) en los niveles superiores más secos. En las subeflorescencias localizadas en el interior de los sistemas porosos, las formas más abundantes son ecuantes y compactas cuando existe un suministro contínuo de agua que garantice el recubrimiento de las paredes de los poros. Esto aplica generalemente a zonas de ascenso capilar, ya que las áreas afectadas por infiltración de agua de lluvia se caracterizan por estadios intermedios de secado debido al suministro irregular del agua (particularmente en nuestro clima). Por consiguiente, en estas últimas zonas las sales pueden presentar formas muy variadas.
4.Mecanismos de Deterioro por Precipitacion e Hidratación de Sales
El proceso de cristalización de sales en el interior de un material poroso debido a la evaporación de disoluciones acuosas supone el crecimiento de cristales en el interior de los poros, lo cual genera presiones sobre las paredes de los mismos que pueden dar lugar a la fracturación y pérdida de cohesión. Aunque este proceso es puede constatarse por las observaciones de objetos naturales y ensayos de laboratorio, se conoce poco sobre los procesos reales de detalle que tienen lugar.
Presiones dirigidas en un medio poroso pueden generarse por cristalización, hidratación y expansión térmica diferencial. Obviamente, el deterioro de un material sometido al efecto de las sales solubles ocurre siempre que las sales se localicen en los poros o cavidades. En medios no confinados, como la superficie exterior de los objetos, las presiones dirigidas son nulas. Por ello, el efecto mecánico de las eflorescencias es nulo, y si existe es debido a que parte de las sales se encuentran justamente de bajo de la superficie.
4.1.Presión de Cristalización de Sales
Si bien el proceso de evaporación no ofrece problema interpretativo alguno, el porqué la cristalización de sales procede en contra de las paredes de los poros, esto es, en contra de la resistencia mecánica de la roca confinante sí ofrece dificultades.
Para explicar este proceso generalmente se invoca la cristalización a partir de una solución sobresaturada. Como hemos visto, la cristalización de sales necesita de una cierta sobre saturación de la solución. La presencia de una solución sobresaturada en el sistema poroso de rocas y morteros permite explicar el crecimiento de cristales de sales en un ambiente confinado, en contra de las paredes de los poros. Las sales presentan mayores solubilidades bajo presiones elevadas que a presiones atmosféricas (P = 1 atm). Esto signifiva que las curvas de saturación en equilibrio para una sal dada se desplazarán hacia el campo de sobresaturación correspondiente a una presiones atmosféricas al aumentar la presión (P2>P1=1 atm, Figura 15). Por lo tanto, una solución sobresaturada a presión atmosférica puede producir la cristalización de sales en equilibrio a presiones mayores. De esta manera, es posible explicar porqué los cristales de sales crecen en contra de las paredes de los poros y capilares, ejerciendo esfuerzos sobre las mismas.
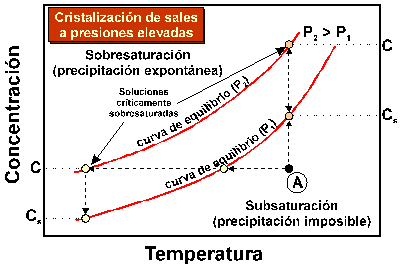
Figura
15. Diagrama esquemático
temperatura-concentración de soluto, con indicación de las curvas de equilibrio
(saturación) para dos presiones distintas, P1 (e.g.,
1 atm) y P2>P1 (compárese con
Las relaciones cuantitativas entre las distintas variables pueden aproximarse mediante la siguiente ecuación, que describe una situación unidimensional (esfuerzos lineales):
(P-1)·Vs = R·T·ln(C/Cs)
donde P es la presión lineal bajo la que cristaliza el cristal, Vs es el volumen molar de la sal sólida, R es la constante de los gases perfectos (8.3143 J·K¾1·mol¾1), T es la temperatura absoluta (K), Cs es la concentración de saturación sin influencia de la presión, esto es, la concentración de saturación en equilibrio para la temperatura T, y C es la concentración de sobresaturación, a la que la solución y la sal sólida están en equilibrio a la presión P.
Siguiendo esta aproximación, pueden
calcularse las presiones máximas que algunas sales desarrollan al cristalizar a
partir de soluciones con variable grado de sobresaturación y distintas
temperaturas (Figura 16, Tabla 3). En
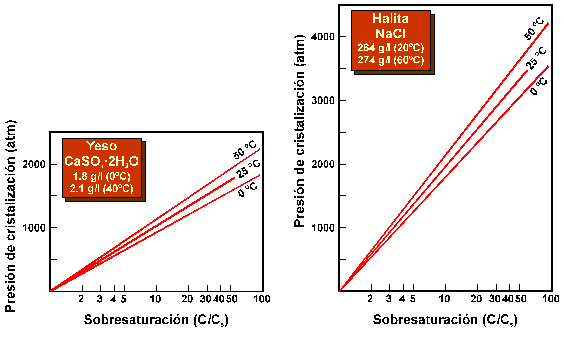
Figura 16. Presiones de cristalización del yeso y halita a distintas temperaturas y grados de sobresaturación (C/Cs), en escala logarítmica natural. (tomados de Winkler, 1973). Nótese que para grados de sobresaturación extremos pueden alcanzarse presiones de varias centenas o miles de atmósferas.
Sin embargo, estas condiciones son bastante teóricas. En primer lugar hay que tener en cuenta que las soluciones naturales localizadas en un sistema poroso no suelen estar saturadas inicialmente, por lo que el grado de sobresaturación por descenso de temperatura o evaporación es limitado (esto es, C/Cs es bajo). En segundo lugar, el ya comentado comportamiento intermedio entre una trayectoria instantánea de sobresaturación y la cristalización en equilibrio que no genera sobresaturación alguna. Otro punto a tener en cuenta es la entidad de los cambios de temperatura, que sólo en algunos ambientes extremos (áridos y semiáridos) serán de entidad suficiente para generar sobresaturación. Además, no se ha tenido en cuenta las condiciones de confinamiento limitado, que pueden generar relajación de los esfuerzos al permitirse cierta adaptación de los cristales a los poros y conductos.
Tabla 3. Presiones
de cristalización (atm) de algunas sales (tomado de Winkler, 1973). C/Cs=grado de
sobresaturación.
Vol molar C/Cs=2 C/Cs=10 C/Cs=50
Sal (cc/mol)
Anhidrita Ca(SO4) 46 335 398 1120 1325 1900 2262
Bischofita MgCl2·6H2O 129 119 142 397 470 675 803
Dodecahidrato MgSO4·12H2O 232 67 80 222 264 378 450
Epsomita MgSO4·7H2O 147 105 125 350 415 595 708
Yeso CaSO4·2H2O 74 282 334 938 1110 1595 1900
Halita NaCl 28 554 654 1845 2190 3135 3737
Heptahidrita Na2CO3·7H2O 154 100 119 334 365 568 677
Hexahidrita MgSO4·6H2O 130 118 141 395 469 671 800
Kieserita MgSO4·H2O 57 272 324 910 1079 1543 1840
Miralbita Na2SO4·10H2O 220 72 83 234 277 397 473
Natrón Na2CO3·10H2O 199 78 92 259 308 440 524
Tachhidrita Mg2CaCl6·12H2O 310 50 59 166 198 282 336
Thenardita Na2SO4 53 292 345 970 1150 1650 1965
Thermonatrita Na2CO3·H2O 55 280 333 935 1109 1590 1891
Estas consideraciones conducen a no
sobreestimar la acción de la cristalización de sales en los materiales de
construcción, aunque en una gran mayoría de los casos, cierta sobresaturación
es esperable, y por lo tanto ciertos esfuerzos disruptivos. Como ejemplo,
tomemos la halita. En
La expresión anterior puede despejarse para cualquiera de las variables. Así por ejemplo, si se conoce la resistencia a la rotura de un material, se puede investigar cuales serían las condiciones de sobresaturación de una solución que podría romper el material. En este caso, consideraríamos la presión máxima teórica como la resistencia a la rotura del material. Conociendo el resto de las variables (T y Vs) se despejaría C/Cs, de manera que:
C/Cs = exp((P-1)·Vs/(R·T))
De esta manera, se pueden evaluar la capacidad de distintas sales para romper un material concreto, teniendo en cuenta que estos cálculos son aproximaciones teóricas, y que no contemplan la posibilidad de un sistema parcialmente confinado.
4.2.Presión de Hidratación de Sales
Las transformaciones de fase que implican hidratación/deshidratación suponen importantes cambios de volumen. En consecuencia, las presiones generadas por la hidratación de sales pueden llegar a ser muy importantes. Para condiciones de reacción de hidratación en equilibrio, la siguiente expresión puede aplicarse para calcular las presiones de hidratación en función de la temperatura y la humedad relativa ambiental:
P - 1 = (n·R·T)/(Vh-Va)·2.3·log(Pw/Pw')
donde P es la presión de hidratación (atm), n es el número de moles de agua ganados en la hidratación, R es la constante de los gases perfectos (82.07 cc·atm/mol·K), T es la temperatura absoluta (K), Vh es el volumen de la fase hidratada (cc/mol), Va es el volumen de la fase anhidra o con menor hidratación (cc/mol), Pw es la presión de vapor de agua a la temperatura T, y Pw' es la presión de vapor de agua en la sal hidratada.
A partir de esta expresión se pueden derivar
diagramas de presión (de hidratación)-temperatura-humedad relativa, que
permiten visualizar mejor sus relaciones. En

Figura 17. Presiones de hidratación de basanita (hemihidrita) a yeso a distintas temperaturas y humedades relativas.
La expresión anterior es teórica, desarrollada para un sistema poroso idealmente confinado y que tenga aporte ilimitado de vapor de agua (humedad) hacia los cristales de sal. Por lo tanto, las presiones de hidratación calculadas son las máximas teóricas, que pueden no corresponderse con las desarrolladas en un sistema poroso real.
Por otra parte, la expresión está derivada para la transición de fase en condiciones de equilibrio. Sin embargo, es muy común que las transiciones de fase en estos procesos de hidratación no se verifiquen en condiciones de equilibrio, sino que una fase puede persistir de forma metaestable en el campo de estabilidad de la otra fase. Este hecho realza los efectos de los procesos de hidratación, ya que las sobrepresiones se alcanzan rápidamente, en contraste con un proceso en equilibrio que es lento.
|
Tabla 4. Presiones de hidratación (atm) para algunas sales solubles a distintas temperaturas
y humedades relativas (tomado de Winkler, 1973). HR (%) Temperatura (ºC) Basanita (CaSO4·0.5H2O) a yeso (CaSO4·2H2O) 0 20 40 60 100 2190 1755 1350 926 90 2000 1571 1158 724 80 1820 1372 941 511 70 1600 1145 702 254 60 1375 884 422 50 1072 575 88 Kieserita (MgSO4·H2O) a hexahidrita
(MgSO4·6H2O) 65.3 100 418 90 226 80 13 Hexahidrita (MgSO4·6H2O) a epsomita (MgSO4·7H2O) 10 20 30 40 100 146 117 92 96 90 132 103 77 69 80 115 87 59 39 70 97 68 40 5 60 76 45 17 50 50 19 40 20 Thermonatrita (Na2CO3·H2O) a Heptahidrita (Na2CO3·7H2O) 0 10 20 30 100 938 770 611 430 90 799 620 457 276 80 673 455 284 94 70 488 264 88 60 243 46 Heptahidrita (Na2CO3·7H2O) a natrón (Na2CO3·10H2O) 0 10 20 30 100 816 669 522 355 90 666 504 350 185 80 490 320 160 70 282 112 60 60 |
Por lo tanto, las presiones de hidratación se pueden generar:
· En un proceso en equilibrio, siempre que los poros esten confinados (presión máxima), o relativamente confiandos, y exista acceso de vapor a las sales, por cambios progresivos en las condiciones termohigrométricas del medio. En este caso las presiones se alcanzan lentamente.
· En un proceso de transición de fases en desequilibrio por cambios en las condiciones del medio y permanencia de la fase inestable en el campo de estabilidad de la fase estable. En este caso las presiones se alcanzan rápidamente.
Los efectos de la hidratación de sales son muy variados, dependiendo del tipo de sales involucradas y de las características del material y de las condiciones termohigrométricas del medio ambiente. El yeso, por ejemplo, suele considerarse como una sal muy agresiva, tanto por su frecuencia en los materiales constitutivos de muros y revestimientos como por las presiones que puede llegar a desarrollar. Sin embargo su efecto depende drasticamente de la sal de la que derive. Así, si la sal precursora es anhidrita, las presiones teóricas máximas pueden llegar a 2800 atm, aunque los efectos no son tan importantes como los desarrollados si la fase precursora es la basanita, ya que en el primer caso, la transición es lenta, pudiendo permanecer la anhidrita como fase metaestable y no transformarse a yeso, mientras que en el segundo caso la transición es rápida, pudiendo hidratarse y deshidratarse en ciclos de tiempo muy cortos (a escala diaria). La hidratación de los sulfatos de Mg (kieserita a hexahidita, a epsomita y a dodecahidrato) no es muy importante, dado que no desarrollan presiones elevadas. Los carbonatos de sodio se encuentran frecuentemente en muchas rocas y morteros alterados, si bien desarrollan presiones bajas y son muy solubles. El proceso de hidratación de los sulfatos de sodio (thenardita a miralbita) es más rápido que el del resto de las sales, pudiendo darse varias veces al día; esto hace que aún desarrollando presiones de hidratación moderadas, los procesos de deterioro pueden ser muy importantes.
5.formas de alteración
De todo lo expuesto, puede deducirse que la acción mecánica de las sales en los materiales pétreos puede ser muy importante, siempre que se desarrolle en un sistema poroso confinado o parcialmente confinado. Esto es poco probable en los sistemas porosos originales de los materiales, aunque localmente puede producirse un cierto grado de confinamiento debido al bloqueo de los conductos y poros por la cristalización de las propias sales. En estos casos, los efectos mecánicos discutidos pueden llegar a disgregar y romper las rocas. En cualquier caso, una evaluación del comportamiento integral de las sales en el interior del sistema poroso en muy difícil, dadas las numerosas variables que influyen, y que suelen ser mal conocidas (e.g., grado de permeabilidad y confinamiento de poros y conductos, frentes de humedad, influencia de aguas de infiltración, gradientes de temperatura en el interior del material, concentración de las soluciones, etc). Es por lo tanto muy importante conocer lo más exactamente posible el sistema poroso para poder evaluar la acción de las sales.
Existen sin embargo ciertas evidencias que pueden ayudar a simplificar estos procesos. La distribución de sales en el interior de un material expuesto a la atmósfera suele presentar un patrón de fuerte incremento de la concentración a medida que el material es más superficial respecto de la superficie expuesta a la atmósfera. La concentración de las sales aumenta exponencialmente al acercarnos a la superficie, manteniéndose más o menos constante a partir de una distancia determinada. La causa de esta distribución es evidentemente el control que la evaporación y los cambios en las condiciones termohigrométricas del ambiente ejercen sobre los procesos de cristalización de sales. Por lo tanto, los efectos causados por estas sobre las rocas y las formas de deterioro que producen serán superficiales y/o muy próximos a la superficie.
Si la cristalización de sales se produce en la superficie del material se generan eflorescencias, en cuyo caso todos los procesos anteriormente descritos no son operativos dado que los cambios de volumen se dan en un ambiente no confinado. Si la cristalización se produce en el interior del material, aunque cerca de la superficie, se generan subeflorescencias, en cuyo caso los efectos de los procesos anteriormente descritos pueden ser más importantes. Sin embargo, la proximidad de la superficie implica un sistema poroso poco o nada confinado, por lo que es probable que estos efectos sean poco operativos. En cualquier caso, sí se produce un fuerte deterioro debido a la pérdida de cohesión generalizada que implica la disolución del material bajo la superficie y la consiguiente escamación de la superficie.
Por lo tanto, cabe esperar que los efectos mecánicos de los procesos relacionados con la cristalización de sales sean poco importantes respecto de los efectos químicos de los mismos, derivados esencialmente de la disolución del material y el ataque químico de las propias sales.
Las formas de alteración más comunes son la formación de eflorescencias y subeflorescencias, aunque otras formas generalmente atribuidas a la acción de las sales son las alveolizaciones.
El proceso de formación de eflorescencias y subeflorescencias depende del mecanismo de saturación de la solución. En el caso de deberse a evaporación, el proceso está fuertemente condicionado por dos mecanismos concomitantes. Por un lado, la tasa de difusión de vapor de agua a través del material ya seco hacia el exterior, y por otro la tasa de aporte de solución a través de la red porosa bañada hacia el frente de evaporación. Si la velocidad de difusión del vapor es menor que la de migración de la solución, esta última podrá llegar a la superficie externa donde se evaporará y cristalizarán las sales. Se forman en este caso las eflorescencias. Si, por el contrario, la tasa de migración de solución es menor que la tasa de difusión del vapor de agua, el equilibrio se alcanzará a una cierta distancia de la superficie, produciéndose en este caso subeflorescencias. Si el mecanismo de saturación se debe al descenso de la temperatura, entonces lo más probable es que se formen subeflorescencias, dado que la solución contenida en el sistema poroso no se mueve, y por lo tanto la sales cristalizan en el interior del material donde la temperatura desciende lo suficiente para saturar la solución.
Aunque como hemos visto, sólo las subeflorescencias son importantes en los procesos de deterioro de los materiales, la observación de eflorescencias superficiales es importante ya que indican la presencia de soluciones salinas en el interior del material y nos pueden dar una idea del alcance de la migración de agua en el sistema poroso (por ejemplo, del nivel de ascenso capilar). Además, si las eflorescencias están compuestas por sales resistentes, como es el caso de la calcita, pueden producir endurecimientos de la superficie. Esto conlleva el consiguiente "retraso" en la alteración de la superficie respecto del interior, que puede llegar a un estado de pérdida de cohesión tal que la roca sufre un colapso y por lo tanto una desintegración importante casi instantánea (Tabla 3).
Otra forma de alteración comúnmente atribuida a la cristalización de sales sobre, todo en rocas de elevada porosidad, son las alveolizaciones encontradas en las superficies de los materiales pétreos. Su morfología es muy típica, con entrantes y salientes más o menos irregulares y profundos dando un aspecto "craterizado" y acompañado de importante pérdida de cohesión. Según algunas interpretaciones (cf. Lazzarini & Laurenzi-Tabasso, 1986) esta forma de alteración de produce cuando se dan las siguientes condiciones:
· Elevada porosidad de la roca.
· Elevado contenido de sales solubles e higroscópicas.
· Fuerte turbulencia del aire en contacto con la superficie rocosa.
Bajo estas condiciones, el intercambio de vapor de agua entre la piedra y el aire es rápido y continuo, por lo que pueden producirse ciclos de cristalización/disolución y de hidratación/deshidratación de sales. Por otra parte, el movimiento turbulento del aire pone en movimiento el material incoherente producido durante la alteración, ejerciendo una acción mecánica abrasiva que acelerará la pérdida de materia en las zonas especialmente atacadas por las sales. Por lo tanto, mientras que las eflorescencias y subbeflorescencias tenderán a concentrarse en las partes donde se produce preferentemente la evaporación, esto es, en las soleadas, las alveolizaciones pueden desarrollarse también en otras partes.
[1]Realmente la constante de equilibrio se describe en función de las actividades de las sustancias que entran en la reacción de disolución/precipitación. Las actividades son funciones complejas de la concentración, pero para soluciones diluidas como las que aquí nos atañen las funciones de actividad puede asumirse igual a la concentración (i.e., soluciones ideales).
[1]Este resultado se obtiene de la expresión: 8.3143·293·ln(274/264)·0.102·100·0.9678/28 = 32 atm.
Última modificación: 13 febrero 2020 16:58