 ÁCIDO
- BASE
ÁCIDO
- BASE ÁCIDO
- BASE
ÁCIDO
- BASE
![]() Objetivos
formativos. Mapa conceptual.
Objetivos
formativos. Mapa conceptual.
En esta unidad didáctica vas a aprender a diferenciar entre las distintas sustancias, tres grandes grupos:
Como ejemplo de ácido podemos nombrar el "vinagre", que es el ácido acético, como ejemplo de base podemos nombrar el "amoniaco", el producto de limpieza del hogar cuyo nombre químico es amoniaco y como ejemplo de sal tenemos la "sal común" que se usa de manera cotidiana en la cocina, que es el cloruro sódico.
Todas estas sustancias tienen una gran importancia, ya que podemos, haciendo un mal uso de ellas llegar a quemarnos o causarnos algunas enfermedades.
Para evitar dichos problemas has de saber qué fortaleza tiene cada sustancia y como se puede neutralizar, cosa que aprenderás en esta lección.
Esta unidad didáctica va enfocada a alumnos de 1º de
Bachiller y a cualquier persona que esté interesada en conocer ,
a nivel químico, un poco mejor , las sustancias que maneja en su
vida diaria.
Los objetivos de esta unidad didáctica son los siguientes:

1. TEORÍAS DE ARRHENIUS Y DE BRÖNSTED Y LOWRY DE ÁCIDOS Y BASES.
Ej) HCl « Cl- + H+
HNO3 « NO3- + H-
Base.- Es una sustancia que se disocia, produciendo iones hidroxilo OH-.
Ej) NaOH « Na+ + OH-
LiOH « Li+ + OH-
Ej) HCl + H2O « Cl- + H3O+
Base.- Es una sustancia capaz de aceptar un protón ( de un ácido ).
Ej) NH3 + H2O « NH4+ +OH-
El ión hidrógeno, al ser tan pequeño, en disolución acuosa se encuentra hidratado, dando el ión hidronio.
H+ + H2O « H3O+
Los ácidos y las bases pueden ser más o menos fuertes y las reacciones suelen ser rápidas en alcanzar el equilibrio.
A las disoluciones acuosas de ácidos y bases se les puede aplicar las relaciones habituales de los equilibrios químicos.
BOH « B+ + OH- ; Kb = [B+] ´ [OH-] / [BOH]
Hay que señalar que en todas estas reacciones un ácido produce una base conjugada y una base produce un ácido conjugado. Tomemos el ejemplo del ácido acético:
CH3 - COOH + H2O «
CH3COO- + H3O+
a1
b 2 b1
a2
Aquí el hidróxido de aluminio actúa como base débil.
Ej) Al(OH)3 « AlO2- + H3O+
Aquí el hidróxido de aluminio actúa como ácido débil.
Frente a bases fuertes obtenemos lo siguiente:
Al(OH)3 + NaOH « NaAlO2 + 2 H2O
Frente a ácidos fuertes obtenemos lo siguiente:
Al(OH)3 + 3HCl « AlCl3
+ 3 H2O
En este equilibrio las concentraciones de los iones H+
y OH- son muy pequeñas.
HClO4 + H2O « ClO4- + H3O+; Ka =
HCN + H2O « CN- + H3O+ ; Ka = 4’9 ´ 10-10
Ejemplos de bases:
NaOH « Na+ + OH- ; Kb = ¯ ¯
Ca(OH)2 « Ca2+
+ 2 OH- ;
Kb = ¯ ¯

2. CONCEPTO DE pH.
La concentración de iones H3O+ en mol/l suelen variar entre los límites 10-14 y 100. Para expresar estas concentraciones mediante números sencillos Sörensen, en 1909 introdujo el concepto de pH.
pH se define como el logaritmo decimal, cambiado de signo de la concentración de iones H3O+.
pH = -log[H3O+]
Debido al signo negativo la escala de pH va en sentido contrario al de la concentración de H3O+, es decir, que el pH de una disolución aumenta a medida que disminuye [H3O+], o sea la acidez.
Esto puede verse claramente en la tabla:
|
|
|
|
|
|
Básica |
13 12 11 10 9 8 |
10-13 10-12 10-11 10-10 10-9 10-8 |
10-1 10-2 10-3 10-4 10-5 10-6 |
|
|
|
|
|
|
Ácida |
5 4 3 2 1 0 |
10-5 10-4 10-3 10-2 10-1 10-0 |
10-9 10-10 10-11 10-12 10-13 10-14 |
Disolución neutra: pH = 7
Disolución ácida: pH < 7
Disolución básica. pH > 7
Teniendo en cuenta la expresión del producto iónico del H2O, se deduce que a 25ºC se cumple:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
El valor del pH de una disolución tiene una gran influencia en muchos procesos químicos y biológicos , por la que su conocimiento es muy importante. Solo en los casos sencillos de disoluciones preparados puede calcularse el pH. En la mayoría de los casos prácticos tanto industriales como biológicos, es necesario medir el pH, lo que se hace con unos aparatos especiales llamados pehachímetros.
De una manera aproximada puede conocerse el pH de una disolución utilizando los indicadores, que son disoluciones de ciertos colorantes orgánicos complejos, cuyo valor cambia con el pH del medio en que se encuentre. Los indicadores son ácidos o bases débiles que se caracterizan por tener distinto color el ácido que se base conjugada.
Ej) Indicador del tipo ácido débil:
InH + H2O « In-
+
H3O+
Color 1
Color2
Para que se aprecie bien el cambio de color, las concentraciones de la forma ácida HIn y de la básica, In- debe ser bastante deferente; luego, el cambio de color no se produce a un pH fijo, sino en un intervalo de pH de unas dos unidades.
Otro tipo de indicadores son los de papel.

El comportamiento ácido o básico de las disoluciones acuosas de sales neutras se debe a que, al menos, uno de los iones de la sal reacciona con el agua y se produce la hidrólisis.
Desde el punto de vista cualitativo, pueden presentarse 4 casos distintos:
HCl + NaOH « NaCl + H2O
Ej) NaCl, KI, NaNO3, etc.
Al disolver NaCl en H2O se disocian completamente los iones Na+ y Cl-. El anión Cl- es una base débil conjugada de un ácido muy fuerte HCl, mucho más débil que el H2O, por lo que no reacciona con esta. Tampoco reacciona con el agua el catión Na+. Es decir, que los iones Na+ y Cl- son muy estables en disolución acuosa y no sufren hidrólisis.
Na+ + H2O ® No reacciona.
Cl- + H2O ® No reacciona
HCl + NH3 « NH4+ Cl-
Ej) NH4Cl, NH4NO3, etc.
HCH3COO + NaOH « Na+CH3COO-
Ej) NaCH3COO, KCN, Na2CO3, etc.
Ej) NH4CH3COO,NH4CO3
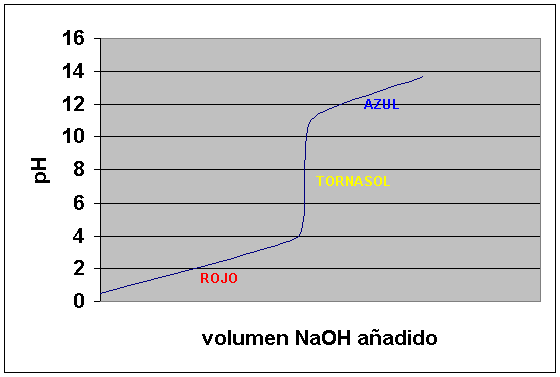
Un método muy sencillo para determinar la concentración desconocida de un ácido (o base) en una disolución, consiste en medir el volumen de otra disolución de concentración conocida de una base (o de ácido) que se necesita para su neutralización. Este procedimiento se llama valoración ácido - base.
Las valoraciones ácido - base tienen su fundamento en el cambio brusco de la concentración de iones H3O+, que se produce en el punto final de la reacción de neutralización o punto de equivalencia.
Ej) Valoramos HCl con NaOH.
Valoramos 50 cm3 de una disolución 0,1M de HCl con otra disolución 0,1M de NaOH.
La concentración inicial de iones H3O+
es 0,1M (ácido fuerte disociación total) su pH =1, al ir
añadiendo disolución de NaOH se va neutralizando el HCl,
pero el pH varía muy poco. En el punto de equivalencia el pH=7,
o sea, obtenemos la neutralización. En cuanto se añade un
exceso pequeño, el pH varía mucho y si añadimos un
gran exceso casi no varía.
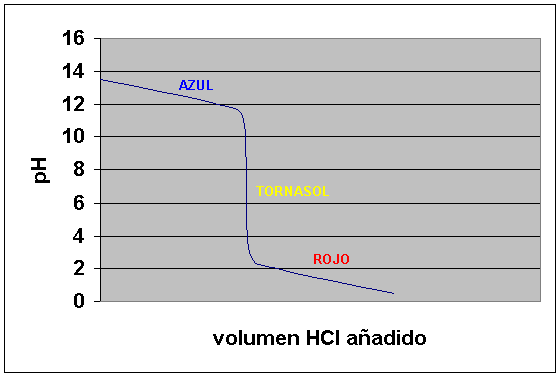
La curva que se obtiene es al contrario en este caso.

1º) Una disolución de un ácido monoprótico del tipo HA titulado 0,2M, tiene una constante de disociación k=5´ 10-4. ¿Cuál será la concentración de HA, A-, y H+?
2º) En una disolución de amoniaco titulada 0,2M deducir las concentraciones de NH3, NH4+, y OH-, sabiendo que la kb=1,8´ 10-5.
3º) ¿Cuál será el pH de una disolución de ácido nítrico 0,2M?
4º) Calcular el pH de una disolución acuosa 0,1M de ácido acético. Dato ka=1,8´ 10-5.
5º) Calcular la concentración del HCl, si para valorar 50ml hemos necesitado 35ml de una disolución de KOH 0,2M.
6º) Calcular el pH de una disolución 0,2M de H2SO4.
7º) Calcular el pH de una disolución de ácido H3PO4 1´ 10-2.
8º) Calcular el pH de las siguientes disoluciones acuosas:
b. 0,025M de KOH.

RESULTADOS
1º) AH + H2O « A-
+ H3O+
0,2
0 0
0,2-X
X X
5´ 10-4= X2 / (0,2 - X)
1´ 10-4 - 5´ 10-4 ´ X = X2 ; X2 + 5´ 10-4 ´ X - 1´ 10-4= 0
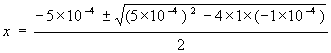
[H3O+] = [A-] = 0,0195
[AH] = 0,2 - 0,0195 = 0,1805
2º) NH3 + H2O «
NH4+ + OH-
0.2
0 0
0.2-X
X X
1,8´ 10-5 = X2 / ( 0,2 - X )
3,6´ 10-6 - 1,8´ 10-5 ´ X = X2
X2 + 1,8´ 10-5´ X - 3,6´ 10-6 = 0
![]()
[OH-] = [NH4+]= 1,8´ 10-3 mol/l
[NH3]= 0,1982 mol/l
3º) HNO3 + H2O « NO3- + H3O+
[HNO3] = [H3O+] = 0,2M
pH = -log [H3O+] = -log(0,2) = 0,7 = pH
4º) CH3COOH + H2O «
CH3COO- + H3O-
0.1-X
X X
ka = X ´ X / ( 0,1 - X ) = 1,8´ 10-5;
pH = -log [H3O+] = -log ( 1,34´
10-3 ) = 2,9 = pH
N= 0,2´ 35 / 50 = 0,14 N = [HCl]
6º) H2SO4 «
2 H+ + SO42-
2X
7º) 3 H2O + H3PO4 «
3 H3O+ + PO43-
3X
8º) a. Se trata de un ácido fuerte, HNO3, por lo que se supone completa la disociación.
[HNO3 = [H3O+] = 0,055M
[KOH] = [OH-] = 0,025
[H3O+] ´ [OH-] = kw
[H3O+] = kw / [OH-] = 1,0´ 10 -14 / 0,025 = 4,0 ´ 10-13
pH = -log [H3O+] = -log ( 4,0´ 10-13 ) = 12,40 = pH
Otra forma de hacerlo:
pOH = -log [OH-] = -log ( 2,5´ 10-2) = 1,60
pH = 14 -pOH = 14 - 1,60 = 12,40 = pH
9º) NH3 + H2O «
NH4+ + OH-
0.1-X
X X
X = [OH-] = 1,34´ 10-3M
[H3O+] = kw / [OH-] = 10-14 / 1,34´ 10-3 = 7,46´ 10-12M
pH = -log [H3O-] = -log ( 7,46´ 10-12 ) = 11,13 = pH
Otra forma de hacerlo:
pOH 0 -log [OH-] = -log (1,34´ 10-3) = 2,87
pH = 14 -pOH = 14 - 2,87 = 11,13 = pH


Manuela Arrebola Jiménez.
Licenciada en Ciencias Químicas.
Universidad de Granada:
Curso: Aplicaciones Educativas de las Nuevas Tecnologías
Informático- Digitales: Internet, Multimedia y Diseño Gráfico.
Director: Dr. Manuel Lorenzo Delgado.
Coordinador: Dr. José Antonio Ortega Carrillo.