|
PROBLEMAS RESUELTOS |
|
CÁLCULO DE PENDIENTES DE REACCIÓN |
| 1- Utilizando la ecuación de Clapeyron calcular: (a) las pendientes de las reacciones; b) dibujar el diagrama. |
|
Reacciones |
Coordenadas T-P de los puntos comprendidos en cada reacción |
|
| Reacción 1 | mon + rnk = wo + mer | 423.17 K, 10.07 x 108 Pa |
| Reacción 2 | 0.5 rnk + mon = 0.75 mer + 0.25 di | 298.17 K, 11.97 x 108 Pa |
| Reacción 3 | 0.5 di + rnk = 0.5 mer + 2 wo | 348.17 K, 15.98 x 108 Pa |
|
Datos termodinámicos |
||
| Mineral | S (J/(K.mol)) | V (m3/mol) |
|
monticellita (mon) |
108.1 | 0.00005148 |
|
diopsido (di) |
142.70 | 0.00006619 |
|
merwinita (mer) |
253.10 | 0.00009847 |
|
wollastonita (wo) |
82.5 | 0.00003993 |
|
rankinita (rnk) |
210.0 | 0.00009651 |
| (a) Pendientes de las reacciones: dP/dT = DS/DV |
| Reacción 1: |
| DS = (82.5 + 253.1) - (108.1 + 210) = 17.5 J/(K.mol) |
| DV= (39.93 x 10-6 + 98.45 x 10-6) - (51.48 x 10-6 + 96.51 x 10-6) = -9.6 x 10-6m3/mol |
|
|
| Reacción 2: |
| DS = ((0.75 x 253.1) + (0.25 x 142.7)) - ((0.5 x 210) + 108.1) = 12.4J/( K.mol) |
| DV = (39.93 x 10-6 + 98.45 x 10-6 ) - (51.48 x 10-6 + 96.51 x 10-6 ) = -9.6 x 10-6m3/mol |
|
|
| Reacción 3: |
| DS = ((0.5 x 253.1)+ (2 x 82.5)) - ((0.5 x 142.7) + 210) = 10.2 J /( K.mol) |
| DV=((0.5 x 98.47 x 10-6)+(2 x 39.93 x 10-6))-((0.5 x 66.19 X x 10-6) + 96.51 x 10-6) = 5.1xl0-7 m3/mol |
|
|
| b) Para poder dibujar el diagrama necesitamos calcular un segundo punto en cada reacción: | |
| Reacción: 1 | Px = 10.07 x 108 Pa+ (-1.8 x 106 Pa/ K x 50 K) = 9.16 x108 Pa |
| Tx = 423.17 K +50 K = 473.17 K | |
| Reacción: 2 | Px = 11.97 x 108 Pa+ (-1.32 x 106 Pa/ K x 50 K) = 11.31 x108 Pa |
| Tx = 298.17 K + 50 K = 348.17 K | |
| Reacción: 3 | Px = 15.98 x 108 Pa+ (-20 x 106 Pa/ K x 50 K) = 5.98 x108 Pa |
| Tx = 348.17 K + 50 K = 398.17 K | |
| c) Proyectamos los 3 pares de puntos (un par por cada reacción): | |
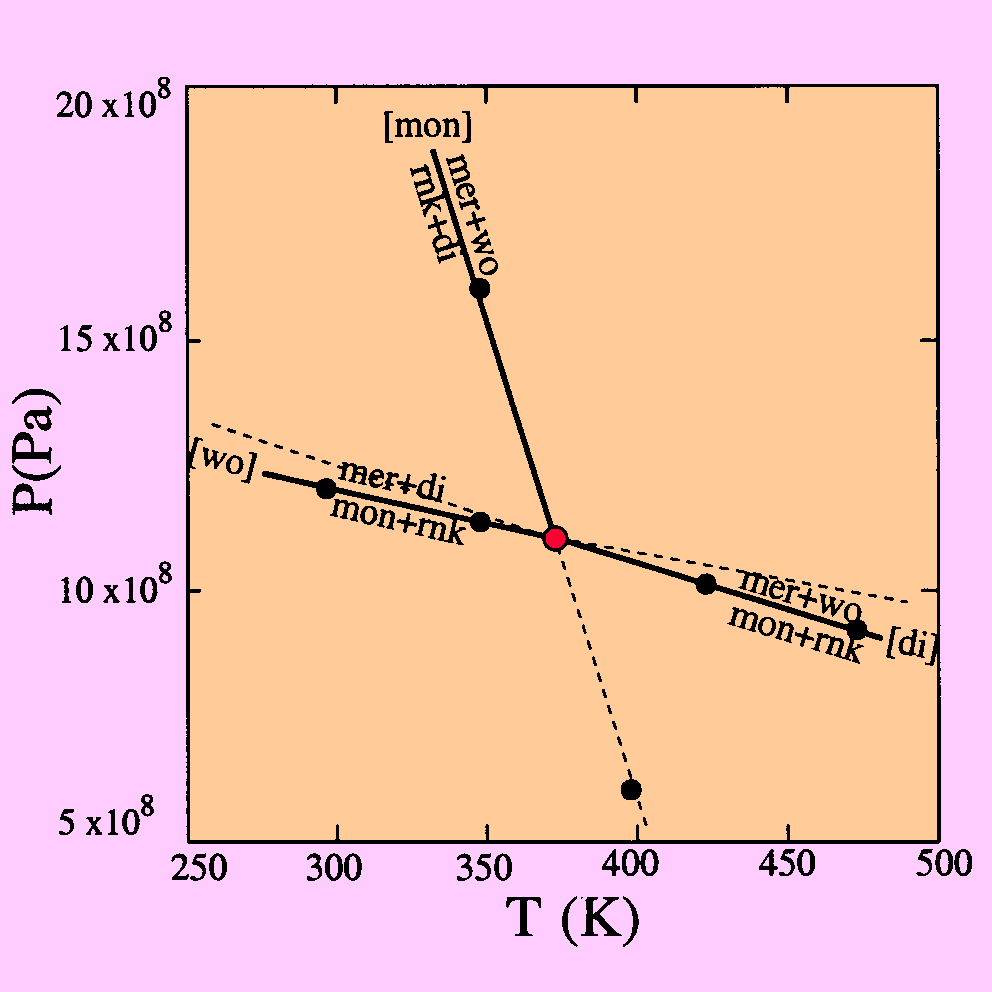 |
Para determinar la extensión estable y |
| metaestable de cada reacción se ha utilizado | |
| la ley de Schreinemacker. | |
| La extensión estable se ha dibujado en línea | |
| continua, y la extensión metaestable en línea | |
| discontinua. | |
| Para distribuir las fases en el diagrama se | |
| han utilizado los volúmenes molares, | |
| según el principio de Le Chatelier. | |
| 2- Utilizando la ecuación de Clapeyron calcular: (a) las pendientes de las reacciones; b) dibujar el diagrama, |
| conociendo el punto invariante que definen las 3 reacciones. |
|
Reacciones |
|
| Reacción 1 | q = trd |
| Reacción 2 | q = crst |
| Reacción 3 | trd=crst |
|
Coordenadas T-P del Punto Invariante |
| 1428,95 K, 1.39 x 108 Pa |
|
Datos termodinámicos |
||
| Mineral | S (J/(K.mol)) | V (m3/mol) |
|
cuarzo (q) |
41.5 | 0.00002269 |
|
tridimita (trd) |
46.50 | 0.00002700 |
|
cristobalita (crst) |
46.1 | 0.00002610 |
| (a) Pendientes de las reacciones: dP/dT = DS/DV |
| Reacción 1: |
| DS = 46.1- 41.5 = 4.6 J/(K.mol) |
| DV= 27 x 10-6 - 22.69 x 10-6 = 4.31 x 10-6 m3/mol |
|
|
| Reacción 2: |
| DS = 46.5 - 41.5 = 5 J/( K.mol) |
| DV = 26.1 x 10-6 - 22.69 x 10-6 = 3.41 x 10-6m3/mol |
|
|
| Reacción 3: |
| DS = 46.5 - 46.1 = 0.4 J/( K.mol) |
| DV = 26.1 x 10-6 - 27 x 10-6 = -0.9 x 10-6m3/mol |
|
|
| b) Para poder dibujar el diagrama necesitamos calcular un segundo punto en cada reacción: | |
| Reacción: 1 | Px = 1.39 x 108 Pa + (10.66 x 105 Pa/ K x 100 K) = 2.45 x108 Pa |
| Tx = 1428.95 K + 100 K = 1528.95 K | |
| Reacción: 2 | Px = 1.39 x 108 Pa+ (14.66 x 105 Pa/ K x 75 K) = 2.49 x108 Pa |
| Tx = 1428.95 + 75 K = 1503.95 K | |
| Reacción: 3 | Px = 1.39 x 108 Pa+ (-4.4 x 105 Pa/ K x 150 K) = 0.7 x108 Pa |
| Tx = 1428.95K + 150K = 1575.95 K | |
| c) Proyectamos los 3 puntos calculados para cada reacción y los unimos con el punto invariante. De esta forma | |
| tenemos las 3 reacciones: | |
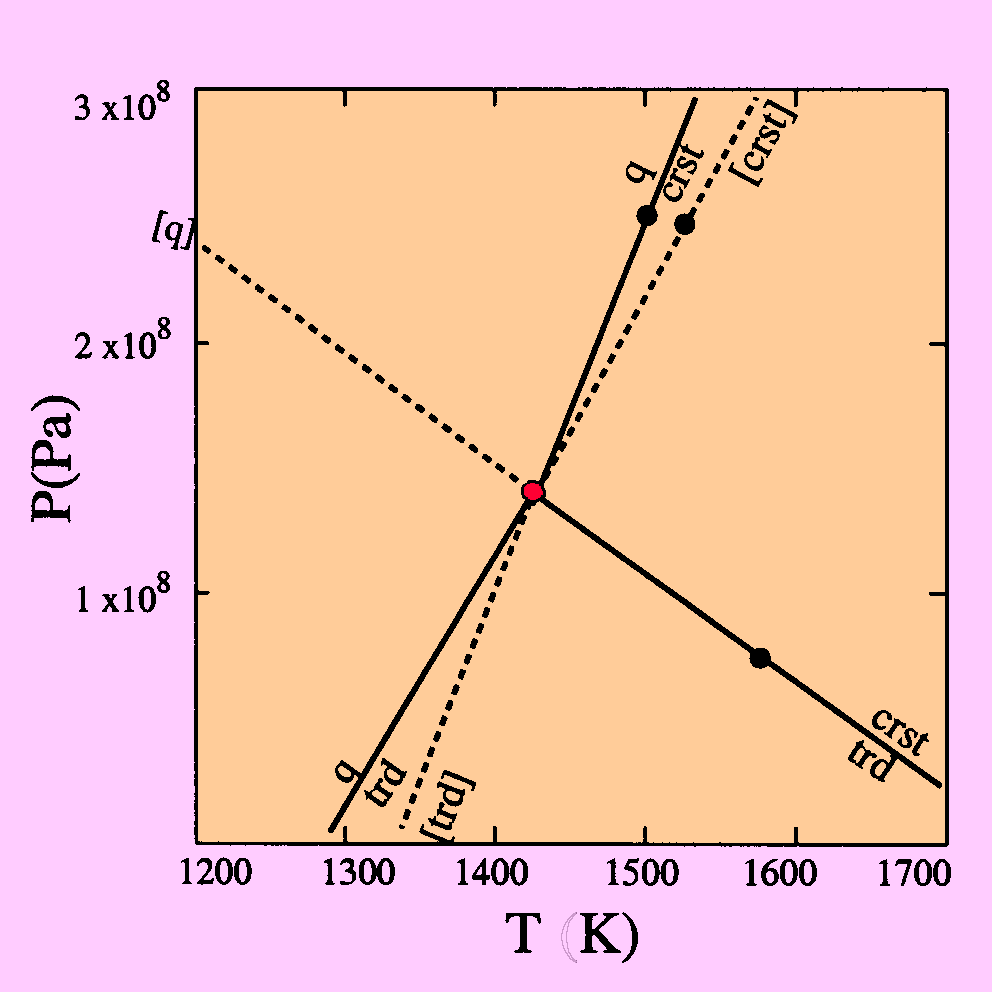 |
Para determinar la extensión estable y |
| metaestable de cada reacción se ha utilizado | |
| la ley de Schreinemacker. | |
| La extensión estable se ha dibujado en línea | |
| continua, y la extensión metaestable en línea | |
| discontinua. | |
| Para distribuir las fases en el diagrama se | |
| han utilizado los volúmenes molares, | |
| según el principio de Le Chatelier. | |