

1 INTRODUCCION: EFECTO DE LOS FACTORES AMBIENTALES SOBRE LOS PROCARIOTAS
2.1 EFECTO DE LA TEMPERATURA SOBRE EL CRECIMIENTO
2.2 CLASES DE MICROORGANISMOS SEGÚN LA TEMPERATURA: ADAPTACIONES EVOLUTIVAS
2.2.1 MICROORGANISMOS PSICRÓFILOS
4 EFECTO DE LA DESECACION SOBRE LAS BACTERIAS
5 EFECTO DE LAS RADIACIONES SOBRE LAS BACTERIAS
5.1 CONCEPTOS GENERALES SOBRE RADIACIONES Y BIOMOLÉCULAS
5.2 EFECTOS DE LAS RADIACIONES IONIZANTES Y SUS APLICACIONES
5.3 EFECTOS DE LAS RADIACIONES ULTRAVIOLETA
5.3.1 FOTOPRODUCTOS DEL ADN OCASIONADOS POR LA LUZ UV
6 EFECTOS DE LAS ONDAS SONORAS
7 EFECTO DE LA PRESION HIDROSTATICA
8 EFECTOS DE LA PRESIÓN OSMÓTICA
![]()
Debido a su pequeño tamaño y a su estilo de vida individual, las células procarióticas sufren los cambios ambientales de un modo mucho más directo e inmediato que las células de los organismos pluricelulares. A lo largo de miles de millones de años, los procariotas han venido estando sometidas a diversas presiones ambientales, y han respondido evolutivamente creando numerosos mecanismos de adaptación. Actualmente, las únicas formas de vida existentes en determinados ambientes extremos son exclusivamente procarióticas. Desafiando a nuestras ideas preconcebidas de lo que es la vida “normal”, encontramos extraordinarios seres vivos unicelulares viviendo “cómodamente” a pHs muy ácidos o muy alcalinos, medrando en salmueras y salinas, o reproduciéndose a temperaturas de más de 100ºC y a grandes presiones. Este tipo de microorganismos que habitan medios que los humanos consideramos como “extremos” reciben el calificativo de extremófilos. En este capítulo veremos algunas de estas notables adaptaciones.
Hasta ahora hemos venido considerando el crecimiento de las bacterias en función de su fondo genético, en relación con los nutrientes, y en unas hipotéticas condiciones ideales (óptimas). Sin embargo, el trabajo experimental con microorganismos ha de tener en cuenta los factores ambientales, es decir, una serie de agentes físicos y químicos que
1) modifican la velocidad de crecimiento, provocando cambios que, a determinados valores de dichos factores pueden llegar a ocasionar la muerte de microorganismos;
2) condicionan la distribuición de los microorganismos en sus ecosistemas y hábitats naturales;
3) permiten a los humanos controlar el crecimiento microbiano, por medio de la fijación de parámetros para:
a) la mutagénesis,
b) la esterilización y desinfección,
c) la quimioterapia.
No todos los microorganismos toleran del mismo modo un determinado factor ambiental. Así, unas determinadas condiciones pueden ser nocivas para una especie bacteriana, y en cambio ser neutras o beneficiosas para otra.
Antes de abordar el estudio de distintos agentes ambientales, conviene distinguir entre los efectos que un determinado agente puede tener sobre la viabilidad y los efectos que pueden simplemente afectar al crecimiento, a la capacidad de diferenciación (si la hubiera) o de reproducción.
Los principales tipos de factores a considerar se pueden desglosar de la siguiente manera:
|
Agentes físicos (tema 13) |
Agentes químicos (tema 14) |
|
Temperatura |
Desinfectantes y antisépticos |
|
Desecación |
Quimioterápicos de síntesis |
|
Radiaciones |
Antibióticos |
|
Ondas sonoras |
|
|
Presión hidrostática |
|
|
Presión osmótica pH |
|
La temperatura es uno de los parámetros ambientales más importantes que condicionan el crecimiento y la supervivencia de los microorganismos.
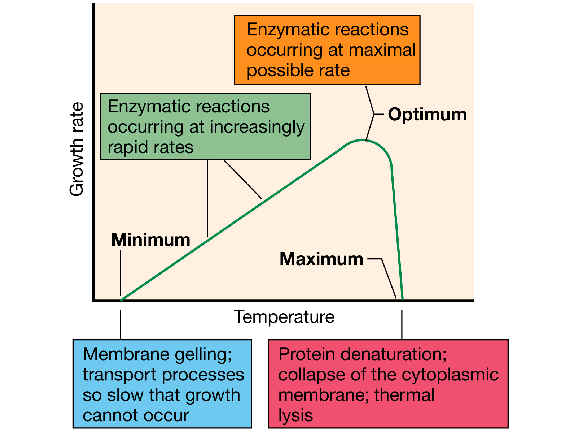
La temperatura afecta a la velocidad de crecimiento (y, por lo tanto al tiempo de generación, g). Cada bacteria (y suponiendo que el resto de condiciones ambientales se mantienten constantes) muestra una curva característica de tasa de crecimiento en función de la temperatura, donde podemos distinguir tres puntos característicos llamados temperaturas cardinales:
 |
|
Temperatura mínima: por debajo de ella no hay crecimiento; | |
|
Temperatura máxima: por encima de ella tampoco existe crecimiento; | |
|
Temperatura óptima: permite la máxima tasa de crecimiento (o sea, g mínimo). |
El margen entre la temperatura mínima y la máxima se suele llamar margen de crecimiento, y en muchas bacterias suele comprender unos 40 grados.
La temperatura mínima se puede explicar en función de un descenso de la fluidez de la membrana, de modo que se detienen los procesos de transporte de nutrientes y el gradiente de protones.
Por encima de la temperatura mínima la tasa de crecimiento va aumentando proporcionalmente hasta alcanzar la temperatura óptima, debido a que las reacciones metabólicas catalizadas por enzimas se van aproximando a su óptimo. En dicha temperatura óptima las enzimas y reacciones se dan a su máxima tasa posible.
A partir de la temperatura óptima, si seguimos subiendo la temperatura se produce un descenso acusado de la tasa de crecimiento hasta alcanzar la temperatura máxima. Dicha temperatura refleja desnaturalización e inactivación de proteínas enzimáticas esenciales, colapsamiento de la membrana citoplásmica y a veces lisis térmica de la bacteria.
Obsérvese en el gráfico que la temperatura óptima está más cerca de la máxima que de la mínima.
Cada especie o cepa bacteriana tiene temperaturas cardinales distintas, de modo que una bacteria puede presentar una temperatura óptima superior a la temperatura máxima de otra, o inferior a la temperatura mínima de una tercera. Según el rango de temperaturas al que pueden crecer las distintas bacterias, se pueden establecer tres tipos principales:
Las psicrófilas o criófilas: crecen a partir de entre -5 a 5ºC.
a) Las llamadas psicrófilas obligadas tienen temperatura óptima a 15-18ºC, como por ejemplo Flavobacterium. La bacteria Polaromonas vacuolata, recientemente aislada en aguas heladas de la Antártida es lo que pudiéramos llamar un psicrófilo extremo: tiene su óptimo de crecimiento en 4ºC, y es incapaz de crecer a 14ºC (¡se muere de calor!).
b) Las psicrófilas facultativas o psicrotolerantes (también llamadas psicrotrofas) presentan temperatura óptima en torno a los 20-30ºC y máximas a los 35ºC. Las bacterias y hongos psicrotrofos son los responsables de que los alimentos guardados en nevera se estropeen al cabo del tiempo.
Ejemplos de medios permanentemente fríos son la mayor parte de las aguas oceánicas (cuya temperatura media es de unos 5oC, pero que en las profundidades alcanzan sólo 1-2ºC por encima de cero) y las áreas permanentemente heladas del Ártico y de la Antártida. En los medios helados existen pequeñas bolsas o microcavidades de agua líquida, donde pueden medrar algunos microorganismos. Un ejemplo no bacteriano muy característico es el alga de las nieves (Chlamydomonas nivalis), que llega a conferir color rojo a la nieve en algunas zonas de montaña a mitad de la estación estival.
Las principales adaptaciones bioquímicas a medios fríos exhibidas por estos microorganismos psicrófilos son:
|
enzimas más resistentes al frío; | |
|
sistemas de transporte adaptados a bajas temperaturas; | |
|
los fosfolípidos de la membrana celular aumentan la proporción de ácidos grasos insaturados (y en algunas bacterias, poliinsaturados, con entre 4 y 9 dobles enlaces); ello supone que la membrana sigue en su estado semifluido, evitándose su congelación. |
Los psicrotrofos (psicrófilos facultativos) son más abundantes, ya que están adaptados a soportar grandes oscilaciones térmicas, y en verano pueden crecer a unos 30ºC-40ºC. Algunas bacterias y hongos pueden crecer en alimentos (carne, leche, frutas y hortalizas) que se guardan en frigoríficos, alterando las cualidades organolépticas e incluso, echándolos a perder (una experiencia que casi todos hemos tenido).
Los mesófilos presentan temperaturas óptimas a los 25-40ºC y máximas entre 35 y 47ºC. La mayor parte de las eubacterias (incluyendo las patógenas) pertenecen a esta categoría. La mayor parte de los microorganismos que viven en ambientes templados y tropicales, incluyendo los simbiontes y parásitos, pertenecen a esta categoría.
Las únicas formas de vida capaces de vivir por encima de 65ºC son todas procariotas. Los termófilos presentan óptimos a 50-75ºC y máximos entre 80 y 113ºC. Dentro de esta categoría se suele distinguir las termófilas extremas (=hipertermófilas), que pueden llegar a presentar óptimos cercanos a los 100ºC, y que taxonómicamente pertenecen al dominio de las Archaea.
Los hábitats naturales con temperaturas permanentemente altas (por encima de 45-50ºC) están restringidos a unas pocas zonas de la biosfera, normalmente relacionadas con fenómenos volcánicos:
|
fuentes termales volcánicas terrestres (en zonas de EE. UU., Japón, Nueva Zelanda e Islandia); | |
|
fuentes termales submarinas: los llamados “humeros” (fumarolas hidrotermales) asociados a las grandes dorsales oceánicas); | |
|
fumarolas | |
|
Los materiales en fermentación como acúmulos de abono (compost) y ensilados pueden alcanzar 65ºC. |
Como ejemplo “clásico”, muy conocido por documentales de divulgación, recordemos que en el famoso Parque Nacional de Yellowstone, en EE UU, existe la mayor concentración mundial de fuentes volcánicas, con géiseres que emiten a más de 100oC, siendo esta temperatura bastante constante, con oscilaciones de +/- 1 ó 2oC. Cuando esta agua sale, lo hace a punto de ebullición. El riachuelo que genera va bajando su temperatura en su recorrido, de modo que se genera un gradiente de temperatura en el que se pueden estudiar fascinantes comunidades microbianas adaptadas a esas diversas temperaturas. Allí fue donde T.D. Brock descubrió la eubacteria termófila Thermus aquaticus, de la que se extrae la ADN polimerasa termorresistente (Taq) empleada en la reacción en cadena de la polimerasa (PCR) automatizada. Recientemente se está recurriendo a usar la polimerasa de una arquea hipertermófila, Pyrococcus furiosus, que funciona muy bien a 100ºC.
|
Los hipertermófilos, con óptimos por encima de los 80ºC son de hecho incapaces de crecer a menos de 37oC, como las citadas arqueas (ej., Thermoproteus, Pyrococcus, Pyrodictium). La arquea Pyrolobus fumarii, habitante de los humeros termales submarinos tiene su óptimo nada menos que a 105ºC y puede llegar a aguantar 113ºC, y parece que detiene su metabolismo (por “frío”) a la “agradable” temperatura de 90ºC (!). | |
|
Las termófilas facultativas pueden crecer a menos de 37ºC, como p. ej. la eubacteria Thermus aquaticus. |
Se han aislado bacterias termófilas en medios artificiales, como calentadores de agua domésticos e industriales.
Las principales adaptaciones bioquímicas a altas temperaturas en células vegetativas bacterianas son:
|
enzimas termorresistentes. Algunas de ellas tienen un interior molecular muy hidrófobo; | |
|
ribosomas termorresistentes; | |
|
membranas ricas en ácidos grasos saturados, que permiten enlaces hidrofóbicos más fuertes. | |
|
En Arqueas hipertermófilas los lípidos son muy especiales: en vez de basarse en ésteres de ácidos grasos con el glicerol, se trata de éteres de hidrocarburos unidos al glicerol (el enlace éter es más resistente). Algunas, además, en vez de la típica bicapa lípídica, exhiben una monocapa bioquímica de C40-bifitanil-tetraéteres (resultado de unirse “cola con cola” dos C20-fitanil-diéteres), que condicionan una extrema resistencia a agentes ambientales. (repasar tema 6). |
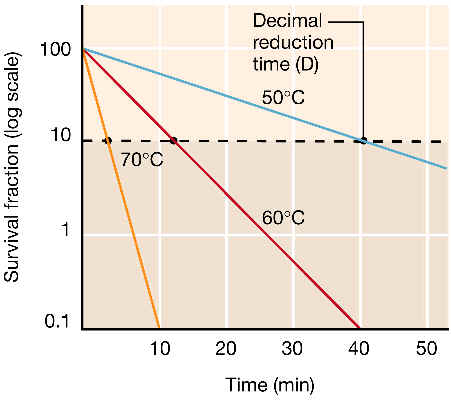
Al subir la temperatura por encima de la temperatura máxima de crecimiento, se dejan sentir los efectos sobre la viabilidad: la pérdida de viabilidad significa que las bacterias dejan de ser capaces de crecer y dividirse, aun cuando las transfiramos a un medio idóneo. La muerte por calor es una función exponencial de primer orden:
dN/dt = -KT·N
O sea, y como se puede constatar en el gráfico adjunto, la acción del calor supone la muerte de una fracción constante (KT) de la población sobreviviente en cada momento.
La cinética de primer orden sugiere que no existen efectos acumulativos, sino que la muerte se debe a la destrucción o inactivación irreversible de una molécula o estructura esencial (como p. ej. el ADN cromosómico o por creación de un daño irreparable en la membrana).
¿Cómo podemos caracterizar o medir en la práctica la inactivación por calor de una suspensión bacteriana? He aquí algunos parámetros utilizados:
|
tiempo térmico mortal: es el tiempo mínimo requerido para que mueran todas las bacterias de una determinada suspensión a una determinada temperatura; | |
|
tiempo de reducción decimal: es el tiempo requerido para reducir al 10% la densidad de la suspensión, a una determinada temperatura (también llamado valor D); | |
|
punto térmico mortal: es la temperatura mínima que mata a todas las bacterias en un tiempo determinado (normalmente el tiempo de referencia empleado es de 10 min). |
Ejemplos
|
punto térmico mortal |
Especies |
|
55oC |
Escherichia coli |
|
60oC |
Mycobacterium tuberculosis |
|
120oC |
endosporas de especies muy resistentes de Bacillus. |
Estos tres parámetros se emplean frecuentemente en industrias alimentarias, como en las de fabricación de conservas, centrales lecheras, etc.
Antes de seguir adelante, es importante tener claro que, dependiendo de la temperatura y el tiempo a que sometamos un material a tratamiento térmico, lograremos inactivación parcial de la población microbiana (es decir, queda una fracción de células viables) o bien esterilización (=inactivación total).
En general, entendemos por esterilización todo tratamiento de un material con un agente físico (como el calor, que nos ocupa en este momento) o químico (como veremos en el capítulo 14) que acarrea la eliminación de toda forma de vida en él. Una vez estéril, el material sigue estéril indefinidamente con tal de que esté encerrado en un compartimento estanco, sellado y libre del contacto con microorganismos del ambiente exterior.
Centrándonos de nuevo en el calor, la inactivación parcial o la esterilización se pueden lograr por calor húmedo o por calor seco.
La inactivación (total o parcial) por calor se debe a la desnaturalización de proteínas y a la fusión de lípidos de membrana, debido a que se rompen muchos enlaces débiles, sobre todo los puentes de hidrógeno entre grupos -C=O y H2-N-. Estos enlaces se rompen más fácilmente por calor húmedo (en atmósfera saturada de vapor de agua), debido a que las moléculas de agua pueden desplazar a los puentes de hidrógeno.
Por lo tanto, la inactivación por calor húmedo requiere menores temperaturas que la que se realiza en ausencia de agua. Veamos algunos ejemplos de condiciones de inactivación total por calor húmedo:
|
Microorganismo |
condiciones |
|
La mayoría de células vegetativas, de bacterias, levaduras y hongos |
80oC , 5-10 min |
|
Bacilo tuberculoso |
58oC , 30 min |
|
Bacilo tuberculoso |
59oC , 20 min |
|
Bacilo tuberculoso |
65oC , 2 min |
|
Staphylococcus aureus, Enterococcus faecalis |
60oC , 60 min |
|
La mayoría de esporas de bacterias patógenas |
100oC , pocos min |
|
esporas del patógeno Clostridium botulinum |
100oC , 5,5 horas |
|
esporas de Clostridium y Bacillus saprofitos |
100oC , muchas horas |
|
esporas de Clostridium y Bacillus saprofitos |
120oC , 15 minutos |
Veamos los métodos principales de lograr esterilización de materiales por calor húmedo:
Autoclave (introducido por Chamberland en 1884): Es un aparato que permite calentar muestras por calor húmedo a temperaturas superiores a las de ebullición del agua (sin que ésta hierva), debido a que el tratamiento se efectúa en un compartimento estanco saturado con vapor de agua y a presiones superiores a la atmosférica. (El funcionamiento del autoclave será oportunamente explicado en clases prácticas). Los parámetros de esterilización suelen ser: temperatura 121ºC y 10-15 min. Como se puede deducir, estos parámetros vienen fijados por la resistencia de las esporas de especies saprofitas (ver última línea de la tabla anterior), que son las formas de vida que más aguantan el calor sin perder viabilidad.
(Hay que tener en cuenta que, en la práctica, a veces hay que emplear condiciones diferentes; por ejemplo: si queremos esterilizar grandes volúmenes de líquido, habrá que prolongar el tratamiento, 30 o 40 min, ya que el centro del recipiente donde va el líquido tarda más en alcanzar la temperatura de esterilización. Los medios de cultivo que incluyen glucosa deben esterilizarse a 115oC, ya que a temperaturas superiores la glucosa "carameliza"; por lo tanto, en estas ocasiones, el tiempo también es mayor: 30 min).
La acción rápida del calor húmedo depende en buena parte del alto valor de calor latente del agua (540 cal·g-1); ello hace que los objetos más fríos (como las muestras a esterilizar) se calienten rápidamente por condensación de agua en su superficie.
Tindalización (nombre en honor de John Tyndall): Es un método de esterilización fraccionada para materiales que se inactivan o estropean a más de 100ºC. Consiste en someter el material a varios ciclos (normalmente 3 ó 4) de dos fases sucesivas cada uno:
a) en la primera fase el material se calienta a una temperatura entre 50 y 100ºC, durante 1 ó 2 horas;
b) en la segunda fase el material se incuba en una estufa, a 30-37ºC durante 24 horas.
Durante las fases de tipo a) mueren todas las células vegetativas de la muestra, pero permanecen viables las esporas, que quedan activadas para germinar. Durante las fases de tipo b) se produce la germinación de las esporas activadas en la respectiva fase anterior. En la siguiente fase de tipo a) morirán las células vegetativas procedentes de la germinación en la fase anterior; y así sucesivamente, hasta que al cabo de unos cuantos ciclos no queda ningun microrganismo en la muestra.
Como se puede ver, este método es bastante engorroso y consumidor de tiempo, por lo que en los últimos años ha sido reemplazado por otro método de esterilización, aunque ya no dependiente del calor: se trata de la esterilización por filtración. Consiste de hacer pasar una solución a través de una membrana o filtro de un tipo de material (normalmente nitrato de celulosa) que presenta poros de un tamaño inferior al de cualquier célula bacteriana (diámetro de poro =0,22 mm).
Aplicaciones principales del calor húmedo:
1. En la práctica cotidiana del laboratorio de microbiología, en la esterilización de medios de cultivo y soluciones.
2. En la esterilización de material quirúrgico.
3. En la esterilización o inactivación parcial, en las industrias alimentarias (conservas, leche y derivados).
a) En la industria láctea se emplean como métodos de esterilización la llamada uperización. La uperización o tratamiento UHT consiste en un tratamiento de calor húmedo donde se emplean temperaturas muy altas durante unos pocos segundos (p. ej.: 135-150ºC durante 1-2 seg).
b) Pero no siempre es imprescindible esterilizar la leche, sino que puede bastar eliminar los posibles microorganismos patógenos que pueden contaminarla, y que son más sensibles al calor que los saprófitos inofensivos. Con esta inactivación parcial de la población microbiana de la leche logramos que ésta se conserve durante unos días, sin alterar apenas sus cualidades organolépticas y nutricionales. He aquí los procedimientos más habituales para conseguir esto:
i. La pasteurización (en honor a Pasteur, que la introdujo en los años 1860) consiste en tratar la leche a 63oC durante 30 min, tras los cuales se enfría y envasa rápidamente.
ii. La pasteurización instantánea (también conocida por sus siglas en inglés HTST, de high temperature-short time) se logra calentando a 72ºC durante sólo 15 segundos, tras de lo cual la muestra se enfría rápidamente. Esta técnica es la más usada actualmente, ya que:
|
mata más rápidamente; | |
|
mata mejor organismos más resistentes; | |
|
altera menos el sabor; | |
|
actúa en flujos continuos (y permite procesar grandes volúmenes de leche). |
Tras la pasteurización, el número de bacterias viables desciende un 97-99%. Los potenciales patógenos que pueda llevar la leche (Brucella, Salmonella, bacilo tuberculoso, Streptococcus, etc) son eliminados fácilmente. La pasteurización también se emplea para la preparación de vacunas a base de microorganismos inactivados por el calor.
Como ya dijimos, la esterilización por calor seco necesita recurrir a mayores temperaturas que la efectuada por el calor húmedo, ya que al no existir agua, la rotura de puentes de hidrógeno y la desnaturalización de proteínas, así como la fusión de membranas, se efectúan a mayores energías. Otros efectos del calor seco son los daños por oxidación y el provocar un aumento de la concentración de electrolitos.
Aplicaciones del calor seco:
1. El llamado horno de Pasteur, mediante calentamiento a 160-170ºC durante 2-3 horas permite esterilizar materiales inertes de laboratorio resistentes al calor: material de vidrio y metálico, aceites y jaleas, etc.
2. Flameado a la llama (hasta el rojo) de asas metálicas de siembra, con las que se inoculan las bacterias.
3. Incineración de materiales de desecho.
Las bajas temperaturas (por debajo de la temperatura mínima) no son útiles para la esterilización, ya que, aunque existen algunas bacterias que mueren por congelación (p. ej., especies patógenas de Neisseria), el efecto de este tratamiento sobre otras muchas es, sobre todo, bacteriostático, sin contar aquellos organismos psicrófilos o psicrotrofos.
Los efectos de someter una suspensión bacteriana a temperaturas menores de 0ºC dependen de:
|
el medio donde están suspendidas las bacterias; | |
|
el modo en que se realice la congelación y una ulterior descongelación. |
Cuando la temperatura es ligeramente inferior al punto de congelación del medio, el citoplasma queda en sobrefusión (sin congelar) entre -1 y -10ºC. Pero como la tensión de vapor de agua en el interior es mayor que en el exterior, existe una tendencia a restablecer el equilibrio, que puede ser:
|
por pérdida de agua de la célula (cuando la congelación se efectúa lentamente), o bien | |
|
por cristalización de agua en el interior (cuando la congelación se realiza rápidamente). |
En ambos casos la consecuencia es que las sales intracelulares se concentran, lo que supone que la solución del citoplasma puede llegar a saturarse, con precipitación de sales. Ello conlleva varias consecuencias: los cristales de sales y la alta concentración de electrolitos provocan la desnaturalización de proteínas y daños a la membrana; otro efecto de menor importancia es el daño mecánico a la pared celular y a la membrana provocado por los cristales de hielo.
En general, el enfriamiento rápido es más lesivo que el lento, existiendo una velocidad óptima. Cuando una bacteria se enfría rápidamente a -35ºC se producen cristales de hielo que provocan daños cuando la muestra se descongela.
Por lo tanto, otro factor a tener en cuenta es la manera de realizarse la descongelación, y el número de ciclos de congelación-descongelación. La descongelación lenta es más letal que la rápida, ya que aumenta el volumen de cristales de hielo.
Aplicaciones de la congelación:
La congelación se aplica, en laboratorio, para preservar muestras bacterianas durante largos periodos de tiempo. Como acabamos de ver, y con objeto de maximizar la viabilidad bacteriana el mayor tiempo posible, es importante cómo se efectúa tanto la congelación como la descongelación. Una vez congeladas, las bacterias supervivientes conservan su viabilidad durante mucho tiempo, siempre que la temperatura se mantenga por debajo del punto eutéctico:
|
en nieve carbónica (CO2 sólido), a -78ºC; | |
|
en nitrógeno líquido, a -180ºC. |
Por ello, este método es usado en el laboratorio para guardar cultivos durante largas temporadas. El inconveniente de emplear nieve carbónica o nitrógeno líquido es que hay que reponerlos con relativa frecuencia. Como veremos enseguida, hay métodos menos engorrosos y caros de mantener viables muestras microbianas durante largos periodos de tiempo.
Para preservar aún mejor las bacterias a bajas temperaturas, se recurre a añadir a la suspensión ciertas sustancias, como por ejemplo:
|
Sustancias no ionizables de bajo peso molecular que provocan la solidificación amorfa y vítrea, en lugar de la cristalización, evitando así la formación de zonas intracelulares con alta concentración de sales: glicerina, sacarosa, lactosa, dimetilsulfóxido (DMSO). | |
|
Materiales ricos en proteína: leche, suero, extracto de carne. | |
|
Proteínas purificadas (p. ej., la albúmina). | |
|
Determinadas macromoléculas: polivinilpirrolidona (PVP), dextranos. |
La suspensión bacteriana puede aguantar varios meses congelada con estas sustancia entre -25 a -30ºC, en congelador. Si se hace con nitrógeno líquido, la conservación puede ser de varios años.
La liofilización es la desecación al vacío de una muestra previamente congelada. Aplicada a bacterias, es uno de los métodos que mantiene por más tiempo la viabilidad bacteriana (varios años). Para obtenerla, el cultivo bacteriano se adiciona de leche o suero (véase epígrafe anterior), se congela sobre nieve carbónica (-78ºC), y se conecta a una bomba de vacío, que provoca la desecación. La eliminación de toda el agua sobre la muestra congelada aumenta la viabilidad de ésta, que se guarda en ampollas cerradas de vidrio a temperatura ambiente, hasta su uso, que como vemos, puede ser incluso muchos años después.
La desecación al aire (sin vacío) mata a las células vegetativas bacterianas, pero no a las endosporas. La sensibilidad a la desecación varía de una especie a otra. Ejemplos:
|
Mycobacterium tuberculosis (el bacilo tuberculoso) es muy resistente al aire (en ausencia de luz), de ahí que pueda aguantar varios meses a partir de los esputos de enfermos. | |
|
En cambio, el vibrión colérico (Vibrio cholerae) muere expuesto al aire al cabo de sólo dos horas. |
Las causas de la muerte son, principalmente:
|
el aumento de concentración intracelular de sales, lo que conlleva efectos tóxicos y desnaturalizantes de proteínas; | |
|
daños por oxidación. |
La mayor eficacia de la desecación al aire se logra con 50% de humedad relativa.
Se puede definir la radiación como la propagación de energía por el espacio. Los principales tipos de radiaciones que pueden tener efectos sobre los seres vivos son:
|
radiación electromagnética |
l (longitudes de onda, en nm) |
|
radiación infrarroja (IR) |
800-106 |
|
radiación visible |
380-800 |
|
ultravioleta (UV) |
13,6-380 |
|
rayos X |
0.14-13.6 |
|
rayos g |
0.001-0.14 |
|
rayos cósmicos |
< 0.001 |
Los efectos derivados de la absorción de radiación dependen de:
|
la energía de la radiación absorbida; | |
|
la naturaleza del material. |
1) Si la energía es E>10 eV, hablamos de radiaciones ionizantes: son los rayos X y los rayos g (estos últimos se emiten como resultado de la desintegración de radioisótopos). Un fotón de gran energía incide sobre un átomo, provocando la expulsión de un electrón de gran energía (fotoelectrón), y quedando el átomo en forma ionizada (cargado positivamente). El electrón expulsado suele tener energía suficiente para originar una nueva ionización, de la cual surge otro electrón de alta energía, etc... produciéndose una cadena de ionizaciones, con transferencia linear de energía, hasta que ésta se disipa en el material: el último electrón de la cadena es captado por otro átomo o molécula, que queda cargado negativamente. El resultado final es que se forman pares de iones (uno positivo y otro negativo). A su vez, esos iones originados tienden a experimentar reorganizaciones electrónicas ulteriores, que dan pie a cambios químicos en el sistema que se había sometido a la irradiación.
2) Si la energía es E<10 eV, no se producen ionizaciones: los electrones del átomo o molécula pasan transitoriamente (de 10-8 a 10-10 segundos) a un nivel energético superior (entonces se habla de que el átomo o molécula están excitados), pero enseguida dicho electrón vuelve al estado energético inicial. En su regreso a su nivel energético previo, el electrón puede dar origen a una variedad de fenómenos:
|
fluorescencia: emisión de energía a una longitud de onda mayor que la del fotón incidente; | |
|
fotosensibilización: la energía se transfiere a otra molécula; | |
|
reacciones fotoquímicas: se origina un cambio químico; | |
|
emisión de calor: la energía simplemente se disipa en colisiones entre moléculas. |
La luz visible y UV pueden dar origen a reacciones fotoquímicas, aparte de calor. Pero la radiación infrarroja sólo conduce a disipación de calor, si bien ciertas bacterias fotosintéticas anoxigénicas pueden aprovechar el infrarrojo para la fotosíntesis.
Aunque la unidad de radiación emitida es el roentgen (R), a efectos biológicos se usan parámetros que miden la energía absorbida por el sistema: las unidades son el rad (100 erg/g) y el gigaray (1Gy = 100 rads).
En general, los microorganismos son más resistentes a las radiaciones ionizantes que los seres superiores. Por ejemplo, la dosis de reducción decimal (D10) para las endosporas de ciertas especies de Clostridium es de 2000-3000 Gy. Las células vegetativas de la bacteria Deinococcus radiodurans (observe el nombre específico) es de 2.200 Gy. Otras especies más “normales” poseen una dosis de reducción decimal en torno a 200-600 Gy. Compara estos datos con el valor de sólo 10 Gy como dosis letal para humanos.
Las fuentes de radiaciones ionizantes son los aparatos de rayos X, los rayos g y los radioisótopos, como el Co60 o el Cs137.
Los efectos de las radiaciones ionizantes son letales, tanto directos como indirectos, así como mutagénicos. Los efectos letales directos se logran a altas dosis de radiación, mientras que los letales indirectos y mutagénicos se consiguen a menores dosis.
1. Efecto letal directo: por impacto de cuantos de radiación ionizante sobre alguna molécula esencial para la vida, que es el ADN (ya que obviamente es absolutamente esencial y suministra una sola copia de la mayoría de los genes bacterianos). Los daños al ADN son, principalmente: roturas en ambas cadenas, y entrecruzamiento entre dichas cadenas, que no puedan repararse.
2. Efecto mutagénico: deriva de la producción de daños menores al ADN que pueden repararse por mecanismos propensos a error.
3. Efecto letal indirecto: este tipo de efecto es el más importante, y deriva de la radiolisis del agua, que genera hidrógeno naciente (H·) y radical hidroxilo (OH·). El radical hidroxilo reacciona fácilmente con macromoléculas, sobre todo con ADN, provocando roturas en ambas cadenas, lo cual se traduce en efectos de letalidad. Si, además, la bacteria está expuesta al oxígeno mientras se la está irradiando, el efecto es aún más intenso, debido a que el O2 reacciona con los radicales libres, originando cadenas de reacciones de autooxidación, muy destructivas, y promoviendo la formación de peróxidos y epóxidos, asimismo letales.
H· + O2 à·HO2
2 ·HO2 à H2O2 + O2
Las principales aplicaciones de las radiaciones ionizantes son la esterilización de:
|
material farmacéutico (antibióticos, hormonas, etc); | |
|
material médico-quirúrgico (guantes de cirujano, suturas de nylon, jeringas desechables, agujas, bisturíes, catéteres, prótesis, etc); | |
|
alimentos envasados (aunque en algunos países aún sigue abierta la polémica por parte de ciertos grupos sobre la seguridad de este tratamiento). |
La radiación UV tiene un efecto letal y mutagénico, que depende de su longitud de onda. Ello se debe a la absorción selectiva de longitudes de onda por parte de ciertas moléculas biológicas:
|
Las proteínas tienen dos picos (es decir, máximos) de absorción: uno a 280 nm, debido a los aminoácidos aromáticos (Trp, Tyr, Phe), y otro a 230 nm, debido a los enlaces peptídicos. | |
|
El ADN y el ARN absorben a 260 nm, debido al enlace doble entre las posiciones 4 y 5 de las bases púricas y pirimidínicas. |
Los rayos UV no tienen actividad ionizante, pero provocan cambios químicos en las moléculas absorbentes, de modo que aparecen moléculas alteradas denominadas genéricamente fotoproductos. Los fotoproductos originan la inactivación de macromoléculas, aunque, como veremos enseguida, el ADN dispone de mecanismos para paliar o eliminar estas modificaciones potencialmente lesivas.
Las consecuencias de inactivar proteínas o ARN no se dejan sentir a efectos de letalidad, ya que existen muchas copias de cada uno de estos tipos de macromoléculas, y se pueden volver a sintetizar. En cambio, la inactivación del único cromosoma de la bacteria tiene efectos letales primarios y efectos mutagénicos secundarios. Por lo tanto, el espectro de acción biológica de la luz UV equivale al de absorción del UV por el ADN (260 nm).
Los fotoproductos generados por la luz UV en el ADN derivan principalmente de alteraciones en las bases pirimidínicas (citosina, timina):
a) dímeros de pirimidina (anillo ciclobutano)
b) fotoproducto de la endospora (5-timinil-5,6-dihidrotimina)
c) hidratos de pirimidina
Los dímeros de pirimidina son los fotoproductos más importantes en las células vegetativas bacterianas. El principal es el dímero de timina (T-T), aunque también se producen T-C y C-C. Como se puede observar, se trata de aductos (uniones) entre dos pirimidinas adyacentes en la misma hebra de ADN, mediante la creación de un anillo de ciclobutano. Su efecto principal es la distorsión local de la configuración de la doble hélice, que interfiere en el normal emparejamiento de bases complementarias; ello, a su vez, provoca una interferencia en los procesos de replicación y transcripción, y secundariamente en el crecimiento y la respiración.
A dosis muy altas de rayos UV se forman también dímeros entre pirimidinas de las dos cadenas, es decir, se provocan entrecruzamientos de las dos hebras que igualmente afectan a la replicación y a la transcripción, aunque este tipo de daños reviste menos significación biológica.
El fotoproducto de la espora es la 5-timinil-5,6-dihidrotimina. Como vimos en el capítulo 9, se forma en la endospora bacteriana debido al alto grado de deshidratación, pudiendo ejercer igualmente efectos inactivantes.
Los hidratos de pirimidina (como la 6-hidroxi-5,6-dihidrotimina) se forman a altas dosis de luz UV. Tienen efecto mutagénico (no letal), favoreciendo la aparición de transiciones T=A a CºG.
Debido al carácter esencial del ADN como molécula central informativa de los seres vivos, la evolución ha desarrollado una serie de mecanismos capacitados para enfrentarse con los posibles daños ocasionados por la luz ultravioleta. Los principales mecanismos hallados en bacterias se pueden agrupar así:
1) Mecanismos prerreplicativos:
a) reparación fotoenzimática o fotorreactivación, que permite la reparación directa del daño en sí
b) reparación por escisión y resíntesis
2) Mecanismos posreplicativos:
a) reparación por recombinación
b) reparación inducible de emergencia (SOS)
A) Reparación fotoenzimática
Se debe a la actuación de una enzima denominada fotoliasa o enzima fotorreactivante, que muchas bacterias sintetizan de manera constitutiva. Las fotoliasas reparan directamente los dímeros de pirimidina, en una reacción que requiere luz visible de 300-500 nm de longitud de onda (luz azul). Estas enzimas poseen dos grupos prostéticos coloreados (cromóforos):
|
flavina reducida (FADH2) | |
|
una pterina. |
Mecanismo
1) La primera fase del mecanismo es independiente de la luz. La fotoliasa reconoce el dímero de pirimidina, y se une a él, formando un complejo enzima-sustrato [E-S].
2) La flavina reducida (FADH2) de la fotoliasa, en presencia de luz (l=300-500), se excita, y dona electrones al anillo de ciclobutano del dímero de pirimidina, rompiéndolo, y regenerando las dos pirimidinas sin alterar.
Aunque se sabe que el segundo cromóforo (la pterina) favorece la reparación, no está claro cuál es su papel exacto.
No todas las bacterias tienen enzimas fotorreactivantes, pero en cambio la fotorreparación está muy extendida entre eucariotas.
B) Reparación por escisión-resíntesis
La distorsión en la doble hélice provocada por el dímero es reconocida por un complejo proteico con actividad de endonucleasa correctora, conocido como correndonucleasa o escinucleasa. El daño se repara indirectamente (es decir, no se actúa sobre el propio fotoproducto), sino que las bases dañadas se eliminan (se escinden) formando parte de un oligonucleótido, y el hueco resultante se rellena por resíntesis reparadora de ADN.
Mecanismo:
1) Un complejo formado por dos subunidades de la proteína UvrA y una de la UvrB (Uvr[A2B]) se une cerca del dímero de pirimidina, usando la energía de la hidrólisis del ATP, y merced a su actividad helicasa, desenrolla localmente la doble hélice.
2) Se une la proteína UvrC, con lo que se completa el complejo Uvr[A2BC], es decir, la correndonucleasa, unido a la cadena dañada del ADN, cerca del dímero.
3) La correndonucleasa realiza dos cortes en la cadena afectada por el dímero: corta el 8º enlace fosfodiéster “a la izquierda” del dímero (o sea, hacia el lado 5') respecto de la localización del dímero y corta el 4º o 5º enlace fosfodiéster “a la derecha” (en dirección 3' del dímero). Por lo tanto, se produce y libera un fragmento de unos 12 nucleótidos de longitud, que incluye al dímero de pirimidina, al mismo tiempo que se retira la escinucleasa, que se separa en sus polipéptidos constituyentes.
4) Queda, pues, un hueco de cadena sencilla en el ADN. Este hueco es ocupado ahora por la ADN-polimerasa-I y por la ADN-helicasa-II (codificada por el gen uvrD), que llevan a la síntesis de nuevo ADN para rellenar el hueco (por supuesto, en sentido 5' à 3'), tomando como molde la cadena intacta, y usando como cebador (“primer”) el extremo 3'-OH que se había generado en la fase anterior.
5) Finalmente, la actuación de la ADN-ligasa sella la cadena (regeneración del enlace fosfodiéster del lado 5').
C) Reparación por recombinación
Cuando la ADN-polimerasa-III bacteriana (que es la enzima que normalmente replica el cromosoma) se encuentra, en la cadena que está usando como molde, con un dímero de pirimidina, deja de replicar esa zona, y “salta” unos 1000 nucleótidos más adelante para seguir la replicación. Por lo tanto, deja un gran hueco o mella de unos 1000 nucleótidos. Esta discontinuidad (llamada mella post-replicativa) se puede rellenar por el mecanismo de reparación por recombinación general, recurriendo a la proteína RecA, que verifica una recombinación con la hebra parental homóloga intacta.
Mecanismo:
1) Numerosas unidades de proteína RecA recubren la zona de cadena sencilla de la mella posreplicativa, formando estructuras helicoidales.
2) La proteína RecA promueve emparejamiento homólogo de la cadena sencilla a la que recubre con la doble cadena “hermana” intacta.
3) Se produce un intercambio recíproco de cadenas.
4) El extremo 3'-OH libre de la cadena dañada (que merced al intercambio recíproco está ahora emparejada con la cadena complementaria procedente de la doble hélice “hermana”) sirve de cebador a la ADN-polimerasa-I, que sintetiza ADN nuevo usando como molde la cadena complementaria intacta del dúplex.
5) Ligación e isomerización espontáneas, que produce la llamada “estructura de Holliday”, una figura en “X” donde hay dos sobrecruzamientos (“crossing-over”) que mantienen unidos entre sí a los dos duplex.
6) Resolución de los dos sobrecruzamientos por sendas roturas y religaciones, lo cual genera dos dobles hélices ininterrumpidas. Como se ve en la figura, uno de estos dúplex lleva el dímero de pirimidina, y el otro es una doble cadena intacta, aunque parte de ella contien ADN de nueva síntesis.
Como se puede ver, el mecanismo de reparación por recombinación no repara por sí mismo la lesión en el ADN, pero logra reparar la mella postreplicativa, evitando que se detenga la replicación del cromosoma. Al final del proceso el dímero como tal sigue sin reparar, pero ahora tendrá una oportunidad de ser reparado por algún otro mecanismo, como el de escisión-resíntesis.
D) Reparación de emergencia (SOS) propensa a error
Cuando la bacteria se somete a dosis elevadas de luz UV o a determinados agentes químicos que dañan severamente el ADN, o que interfieren seriamente con la replicación, puede ocurrir que los sistemas de reparación que hemos visto hasta ahora no sean suficientes para reparar todos los daños; en estas circunstancias se pone en marcha un nuevo mecanismo, que es inducible y que calificamos como de emergencia, ya que tiende a salvaguardar la viabilidad de la célula, a costa de acumular mutaciones con frecuencia elevada (y por eso lo llamamos también propenso a error).
Descripción del sistema en una célula normal (no sometida a daños al ADN):
El gen lexA posee un nivel basal de expresión, de modo que codifica la proteína LexA, que actúa como represor sobre su propio gen (represión autógena), así como sobre los genes recA, uvrA, B, C, umuDC. La represión no es total, sino que se da un nivel basal de producción de los polipéptidos correspondientes a estos genes. Así, por ejemplo, el nivel de proteína RecA es suficiente para efectuar los procesos normales de recombinación, y los niveles de UvrABC son suficientes para reparar pequeños daños en el ADN.
Descripción del sistema en una célula severamente dañada:
Una célula seriamente afectada por un agente que daña el ADN o interfiere con su replicación poseerá zonas de cromosoma con ADN de cadena sencilla (c.s.) sin reparar. Pues bien, este ADN de c.s. constituye una señal de situación de emergencia para la proteína RecA: dicha proteína se une a esas regiones de c.s., de modo que adquiere una actividad proteasa muy específica (para distinguir esta actividad, usamos la nomenclatura RecA*). La proteína RecA* (activada como proteasa) induce la proteolisis del represor LexA (rompiéndolo entre dos aminoácidos concretos hacia la mitad de la molécula). Por lo tanto, ya no hay suficiente proteína LexA intacta como para seguir reprimiendo a los genes citados (recA, uvrABC, umuDC). Dichos genes (llamados genéricamente genes SOS) se pueden expresar ahora a altos niveles, de modo que:
|
Aumentan los niveles de RecA, lo que conlleva un aumento de la eficiencia de la reparación por recombinación; | |
|
Aumentan los niveles de la escinucleasa (Uvr[A2BC]), lo que supone mejorar la reparación por escisión-resíntesis; | |
|
Se expresan los genes umuDC, lo que se traduce en un aumento de la mutagénesis. Pero ¿por qué aumenta la mutagénesis? El mecanismo exacto no está claro. Se sabe que en esta situación de emergencia algunos dímeros de pirimidina son procesados con la intervención de los productos de recA y de umuD y umuC, de modo que hay una síntesis de emergencia de ADN que acarrea la frecuente introducción de bases incorrectas (es decir, es un proceso de reparación propenso a error). |
De esta manera, la célula salvaría su integridad en esta situación “límite”, pero a costa de adquirir frecuentes mutaciones. (¡Es mejor sobrevivir aunque sea con unas cuantas mutaciones a morirse!).
La luz UV se puede producir artificialmente en lámparas de vapor de mercurio de baja presión, que emiten el 90% de su radiación a 254 nm. La unidad de energía de radiación se mide en watts/(seg·cm2).
Por ejemplo, una lámpara de 15 watios emite una energía de 38mwatts·cm-2·seg-1, a una muestra situada a 1 metro de la lámpara.
La luz UV es efectiva sobre bacterias Gram-positivas y Gram-negativas. La dosis letal para células vegetativas suele estar entre 1800 y 6500 mwatt·cm-2, pero las endosporas requieren 10 veces más dosis.
El uso práctico de la luz UV como agente esterilizante está limitado, ya que tiene poco poder penetrante: no entra en objetos sólidos, y además se ve apantallada por el cristal y penetra poco en los líquidos. Su aplicación concreta más frecuente es en el control de infecciones por vía aérea: lámparas de desinfección en salas de hospitales y de laboratorios de investigación. En Microbiología se emplea la luz UV como agente mutagénico en bacterias (en muchos estudios que requieran obtener mutantes correspondientes a cualquier tipo de fenotipos, para conocer las correspondientes bases genéticas).
A diferencia de la UV, la luz visible es de baja energía, y además, sus cuantos no tienen efectos selectivos sobre el ADN, por lo que no sería de esperar, en principio, que este tipo de radiación tuviera efectos negativos sobre las bacterias. Sin embargo, la luz visible puede ejercer un efecto negativo indirecto, en el fenómeno de sensibilización fotodinámica.
La luz visible de fuerte intensidad (p. ej., exposición a pleno sol) es capaz de matar las bacterias, debido a que ciertas moléculas de éstas (riboflavinas, porfirinas, citocromos) absorben la energía de los cuantos y se excitan durante 10-6-10-8 seg, tras lo cual reemiten la energía a otras moléculas, originando fotooxidaciones en residuos His y Trp de las proteínas y en las bases de los ácidos nucleicos. También se puede generar oxígeno singlete (1O2), que es un radical muy reactivo, oxidante, que puede destruir la célula con rapidez.
Así pues, la moraleja práctica es: no dejarse los cultivos bacterianos expuestos a la luz solar, sino que habrán de cultivarse en oscuridad (salvo el cultivo de las bacterias fototrofas).
Ciertas bacterias (entre ellas las fotosintéticas, y las que se propagan vía aérea) poseen abundantes pigmentos de tipo carotenoide que las protegen de estos efectos fotosensibilizadores. (Los carotenoides captan la energía del oxígeno singlete y la reenvían al estado basal, no excitado).
Las ondas sonoras audibles para los humanos poseen un rango de frecuencias entre los 9 kilociclos y los 20 kilociclos/segundo. Por encima de 20 Kc se sitúan las ondas supersónicas (hasta los 200 Kc/seg) y las ultrasónicas (desde 200 hasta 2000 Kc/seg). Estos tipos de ondas de frecuencias superiores a las audibles (sobre todo las ultrasónicas) tienen el efecto de desintegrar las células.
El fundamento de esta acción es el siguiente: el paso del sonido a través de un líquido produce cambios de presión alternantes (por los sucesivos frentes de ondas), que a grandes frecuencias originan cavidades (burbujas de gases disueltos) de unos 10 mm de diámetro (fenómeno de cavitación). Dichas cavidades van aumentando de tamaño y terminan colapsando violentamente, dando lugar a enormes presiones locales (de hasta 1000 atmósferas o 10 Tm/cm2). Las consecuencias del colapso son:
|
la célula se desintegra; | |
|
si existe oxígeno en el líquido de suspensión, se forman peróxidos (como el H2O2); | |
|
despolimerización de macromoléculas; | |
|
cortes en ambas hebras del ADN. |
Las bacterias son variables en cuanto a su susceptibilidad a las vibraciones sonoras. En general, son más sensibles las Gram-negativas y más resistentes las Gram-positivas. Sin embargo, ante un tratamiento por ultrasonidos siempre cabe la posibilidad de que sobrevivan algunos individuos, por lo que este método no tiene utilidad para la esterilización.
El uso habitual de los supra- y ultrasonidos en laboratorio es para la llamada “sonicación” o disrupción ultrasónica de células para obtener extractos celulares, en investigaciones bioquímicas. El tratamiento se realiza en un aparato llamado generador de ultrasonidos o “sonicador”, que opera en un rango de frecuencias desde 9 hasta 100 Kc/seg.
La mayor parte de las especies bacterianas de hábitats continentales no pueden crecer (e incluso mueren) cuando son sometidas a altas presiones (unos 600 Kg/cm2). Ello se debe a los siguientes efectos adversos:
|
aumento de la viscosidad del citoplasma; | |
|
disminución de la capacidad de las enzimas de unirse a sus respectivos sustratos; | |
|
interferencia en la división celular: las bacterias se alargan, se filamentan, pero sin producción de tabique transversal (crecimiento sin división celular). |
Sin embargo, existen bacterias (sobre todo marinas) que toleran o requieren altas presiones (barotolerantes y barófilas, respectivamente):
|
Bacterias barotolerantes: Crecen a la presión atmosférica, pero aguantan hasta unas 500 atmósferas. Su hábitat son las aguas oceánicas, entre los 2000 y los 4000 metros de profundidad. | |||||
|
Bacterias barófilas: Crecen óptimamente a más de 400 atmósferas. Podemos distinguir entre barófilas moderadas (facultativas) y barófilas extremas (obligadas):
|
Aplicación práctica de las altas presiones a bacterias barosensibles:
La llamada prensa de French (que frecuentemente se denomina incorrectamente como “prensa francesa”) es un aparato de laboratorio que permite aplicar grandes presiones y brusca descompresiones, lo que logra la rotura mecánica de las bacterias, con objeto (al igual que la sonicación) de obtener extractos libres de células.
(Repasa en el capítulo 11 el concepto de potencial de agua o actividad de agua, aw)
Exceptuando los micoplasmas, que carecen de pared celular, las bacterias pueden vivir en medios tanto hipotónicos como hipertónicos, debido a la protección de una pared celular rígida y a la membrana citoplásmica semipermeable.
Normalmente el citoplasma de las bacterias poseen una osmolaridad ligeramente superior a la del entorno, lo que garantiza el paso de agua al interior. La presión de turgor es relativamente constante porque la membrana citoplásmica se topa con la rigidez de la pared celular. Esta presión de turgor permite que la bacteria aguante cambios bruscos de concentración de solutos en su entorno (dentro de ciertos límites). Pero esto plantea una pregunta (que intentaremos responder a continuación): ¿cómo logra la bacteria ajustar su osmolaridad interna a esos cambios exteriores?
A) En medios hipotónicos (con una aw>aw del citoplasma) es la pared celular la que ejerce todo el papel: su rigidez se opone a la entrada de agua, y por lo tanto, evita que la membrana citoplásmica tienda a sufrir una presión de turgor excesiva.
B) En medios hipertónicos (cuando la aw del exterior es menor que la del citoplasma). Las bacterias poseen mecanismos compensatorios por los que tienden a aumentar la osmolaridad interior por encima de la del medio (para garantizar la entrada de agua del ambiente y mantener su metabolismo). Ello se logra esencialmente aumentando la concentración de un soluto muy soluble en agua en el interior celular, soluto llamado genéricamente soluto compatible, lo cual se puede lograr por varios posibles mecanismos:
|
bombeando iones al interior; | |
|
sintetizando una molécula orgánica osmóticamente activa; | |
|
bombeando sustancias osmoprotectoras. |
1) En el caso de los iones, el ión bombeado suele ser el potasio (K+), por un sistema de antiporte K+/H+.
2) Como ejemplos de síntesis de solutos orgánicos compatibles y osmóticamente activos tenemos el glutamato, la glutamina y la trehalosa. En levaduras es frecuente que el soluto compatible sea un poliol (sorbitol, manitol, etc.).
Ahora bien, si el medio es muy hipertónico, estos mecanismos ya son incapaces de evitar la salida de agua desde el citosol, lo cual conlleva una retracción de la membrana citoplásmica. La pérdida de agua puede suponer la deshidratación del citoplasma, lo que conlleva la detención del crecimiento.
|
En Gram-positivas se produce una plasmolisis auténtica (retracción de la membrana citoplásmica respecto de la pared rígida suprayacente) | |
|
En Gram-negativas no existe auténtica plasmolisis, ya que la pared celular y la membrana citoplásmica se retraen al mismo tiempo. Las bacteria entéricas crecen lentamente por encima de 0.65M de NaCl. |
3) Sin embargo, las bacterias pueden crecer a osmolaridades superiores a la máxima teórica, si en el medio existen determinados compuestos llamados osmoprotectores. La bacteria bombea esos compuestos a su interior, usándolos como solutos compatibles. Ejemplos de osmoprotectores exógenos que pueden ser bombeados al interior celular:
|
Prolina (p. ej., en Salmonella typhimurium y Staphylococcus aureus) | |
|
Betaína (glicínbetaína), un derivado trimetilado de la glicocola (en cianobacterias y en algunas Gram-positivas). | |
|
Colina (en Escherichia coli). | |
|
Ectoína en enterobacterias. |
Por ejemplo, S. typhimurium crece muy lentamente en 1M de ClNa, pero mejora si al medio se añade 1mM de prolina. Un método normal de aislar S.aureus es comprobar el crecimiento en medio con 7.5% de ClNa en presencia de prolina.
Existen ciertos microorganismos especializados que viven en medios hipertónicos, y en general se llaman osmófilos. Entre los osmófilos podemos distinguir los sacarófilos y los halófilos.
|
Uno de los mejores ejemplos de microorganismos sacarófilos no es una bacteria, sino las levaduras, que viven en jugos vegetales, néctares, zumos, etc. Utilizan como solutos compatibles polioles como el sorbitol, el ribitol, etc. | |||||||||||
|
Entre los organismos halófilos, podemos distinguir los halófilos moderados y los halófilos extremos o hiperhalófilos.
|
Dejando aparte las bacterias halófilas, hay algunas bacterias halotolerantes (como por ejemplo, Staphylococcus aureus), pero la inmensa mayoría de los procariotas viven a valores de actividad de agua de 0.98. Por ello, un método que ya se conocía empíricamente en la antigüedad para conservar ciertos alimentos era el desecarlos o salarlos, o añadirles grandes cantidades de azúcar (como en las mermeladas).
La mayoría de las bacterias pueden crecer dentro de un margen de pH de su medio, manteniendo al mismo tiempo su pH interno óptimo prácticamente constante.
Por ejemplo, Escherichia coli puede crecer bien entre pH 6 y pH 8, pero su pH interno es siempre 7.6 o muy cercano a ese valor.
Respecto del margen normal de pH a los que crecen las bacterias, éstas se pueden clasificar en:
|
Neutrófilas, si crecen de modo óptimo en torno a la neutralidad (entre pH 5.5 y 8). | |
|
Acidófilas, si crecen normalmente entre pH 0 y pH 5. | |
|
Alcalófilas, si crecen entre pH 8.5 y pH 11.5. |
La mayor parte de las bacterias son neutrófilas. Muchas bacterias neutrófilas modifican el pH del medio, y resisten entornos relativamente ácidos o alcalinos. Por ejemplo, algunas bacterias fermentativas excretan ácidos, mientras otras alcalinizan el medio, p. ej., produciendo amonio a partir de desaminación de aminoácidos. Por otro lado, la mayor parte de los hongos y levaduras requieren pHs ligeramente ácidos (en torno a 4-5).
Aunque los microorganismos pueden crecer en un margen más o menos amplio de pH (alrededor de un óptimo), los cambios bruscos pueden ser lesivos (afectando a la membrana y al transporte de solutos, e inhibiendo enzimas). Si el pH citoplásmico cae rápidamente hasta 5 o menos, la bacteria puede morir.
Uno de los mecanismos que, al menos en neutrófilos parece controlar el pH interior es un sistema de antiporte H+/K+: a pH ácidos, el interior celular puede quedar en principio más alcalino que el exterior. Este sistema introduce protones en el interior y saca iones potasio. De esta manera neutralizan el pH interior y siguen teniendo un potencial de membrana para establecer una fuerza protón motriz que les suministre energía.
Si el pH interior cae en torno a 6 o 5.5, bacterias como E. coli o S. typhimurium inducen una respuesta de tolerancia a ácidos, consistente en ATPasas translocadoras de protones (expulsan protones al exterior) y chaperonas (proteínas celadoras) para corregir las proteínas desnaturalizadas.
Existen algunos notables procariotas cuyo pH óptimo es muy bajo (acidófilos extremos u obligados): Algunas eubacterias del género Thiobacillus (T. thiooxidans, T. ferrooxidans) y las arqueas de los géneros Sulfolobus, Thermoplasma y Ferroplasma tienen su óptimo a pH 2, y generan ellas mismas estos bajos pH al oxidar sulfuros hasta ácido sulfúrico. (Sulfolobus es un Secciones un termoacidófilo). De hecho, estas bacterias necesitan esas altas concentraciones de H+ para mantener la integridad de sus membranas y envueltas: a pH neutro esas envueltas se desintegran. Una arquea sorprendentemente acidófila es Picrophilus oshimae, cuyo pH óptimo es nada menos que 0.7 (aparte de que es una termófila que necesita temperaturas de más de 60ºC).
Las especies alcalófilas obligadas tienen óptimos de pH en torno a 10-11. Por ejemplo, Bacillus alcalophilus , cuyo pH interno es de 9. Sus hábitats típicos son suelos carbonatados y lagunas alcalinas (algunos son también halófilos, como Natronobacterim gregoryi). Estos organsimos tienen gran interés industrial, porque de ellos se obtienen enzimas hidrolíticas como proteasas y lipasas que se usan como aditivos en detergentes.
![]()