TEMA 11: ALTERACIÓN EN AMBIENTES CONTAMINADOS
1.Aceleración del deterioro de obras monumentales en ambientes contaminados
Las modificaciones del medio ambiente atmosférico introducidas en los últimos decenios por la actividad humana, esencialmente debidas a la combustión de carburantes naturales, es una de las razones del rápido deterioro observado en el patrimonio munumental de los países industrializados. En numerosos monumentos de estos países han sido observados fuertes deterioros de los materiales pétreos desde principios de siglo, lo cual es indicativo de que el grado de alteración se ha incrementado exponencialmente (Figuras 1 y 2).

Figura 1.- Deterioro acelerado en ambientes contaminados. Escultura de arenisca del Castillo de Herten, Recklinghausen, localizado en la cuenca del Rhin (Alemania) y construido en 1702. Aspecto del motivo en 1908, mostrando deterioro moderado, y en 1969, prácticamente destruido. (de Winkler, 1973, Fig. 72).
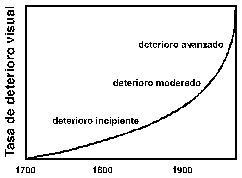
Figura 2.- Estimación visual de la tasa
de deterioro de la escultura de
Aunque existen explicaciones teóricas para justificar este aumento tan drástico de los procesos de alteración, todavía no existen modelizaciones cuantitativas que permitan prever el comportamiento real de los materiales. En cualquier caso, es reconocido que los materiales más susceptibles a alterarse por la acción de los agentes contaminantes son los carbonatados (calizas, mármoles, morteros de cal, ...). Estos materiales están constituidos por minerales carbonatados (calcita y/o dolomita), cuya solubilidad aumenta fuertemente en soluciones ácidas. Esto permite explicar el rápido deterioro de los carbonatos por reacción con ácidos de C, S y N dispersos en la atmósfera en forma de aerosoles, cuyo efecto sobre estos materiales no implica exclusivamente su disolución en soluciones acuosas sino que también inducen el crecimiento de sales solubles. Los materiales silicatados soportan mejor los efectos químicos de la contaminación, aunque bajo condiciones de elevada acidez del medio pueden formarse costras silíceas poco solubles, y en cualquier caso pueden verse afectados indirectamente por la formación de sales solubles procedentes de materiales carbonatados, ya sea por transporte en disoluciones acuosas presentes en los sistemas porosos o por transporte a través del aire en forma de aerosoles.
Sin embargo, existe otro tipo de deterioro que afecta a todo tipo de material localizado en áreas urbanas e industrializadas, no relacionado con procesos de disolución sino con la deposición de materia en suspensión sobre las superficies pétreas expuestas a la atmósfera. La formación de estas costras negras supone un indudable deterioro estético, con ennegrecimiento generalizado de las fachadas, detalles ornamentales, superficies policromadas, etc., que por si solos justificarían su limpieza. No obstante, estas costras disparan procesos de deterioro adicionales de carácter químico y mecánico, por lo que es totalmente ilusorio pensar que la formación de estas costras es beneficiosa para los materiales al protegerlas de ataque ulteriores.
2.Controles
ambientales de la
contaminación
La cantidad y calidad de los agentes contaminantes en una zona determinada depende tanto de las fuentes de emisión como de sus características topográficas, meteorológicas y microclimáticas. De hecho estas características controlan la dispersión y transporte de los agentes contaminantes, lo cual es de gran importancia para favorecer o no los procesos de deterioro inducidos por los mismos.
Es fácil entender que las características del viento (dirección y grado de turbulencia) condicionan el grado de contaminación ya que el viento implica un transporte horizontal del aire, y por lo tanto de los agentes contaminantes. Si las fuentes de emisión son externas a la zona considerada, la dirección de viento condicionará que los agentes contaminantes sean o no transportados fuera de la misma. Si las fuentes de emisión son internas (e.g., calefacciones domésticas, coches,...) el viento permitirá, por lo general, el transporte de los agentes contaminates fuera de la misma.
Otro control muy importante es la
distribución de la temperatura atmosférica en la vertical, ya que condiciona el
movimiento del aire en esta dirección. En general, la temperatura disminuye con
la altura (Figura 3). Para gradientes de más de 1ºC/100
m, se favorece el movimiento ascendente del aire, y por lo tanto la dispersión
de los contaminantes desde las zonas cercanas al suelo. Si, por el contrario,
la temperatura del aire permanece constante (isotermia),
o aumenta con la altura (inversión térmica), el movimiento ascendente del aire
no es posible, manteniendo los contaminantes en las zonas inferiores de la
atmósfera. Ejemplos clásicos del efecto de las condiciones climáticas y
topográficas particulares son Venecia y
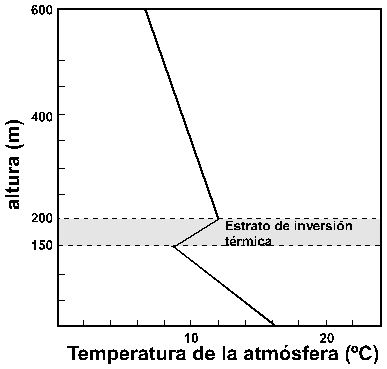
Figura 3.- Variación de la temperatura del aire en función de la altura, con formación de un estrato de inversión térmica. (de Lazzarini y Tabasso, 1986, Fig. 34).
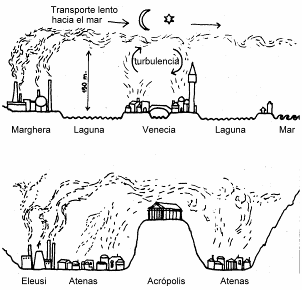
Figura 4.- Representación esquemática de las condiciones geo-climáticas que favorecen la acumulación de los contaminantes atmosféricos en Venecia y Atenas, en una noche invernal. (de Lazzarini y Tabasso, 1986, Fig. 35).
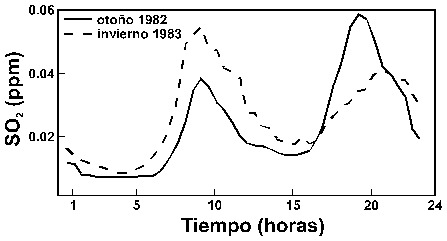
Figura 5.- Variación de la concentración
de SO2 en la atmósfera durante un día completo (media de 20 días),
medida en
Estas consideraciones son importantes dado que los criterios de restauración y conservación son aplicables no sólo a los materiales, sino también al medio ambiente. Hasta ahora las intervenciones se han efectuado, sobre todo, sobre los materiales. Pero dado que no existe un material de restauración milagroso que evite ulteriores daños, es fundamental planificar el territorio para permitir mejorar la calidad de los ambientes a los que están sometidos los materiales (así como los seres vivos). Dada la importancia que actualmente han adquirido los criterios de conservación del medio ambiente y planificación del territorio, es necesario incluir en estos planes una visión relacionada con la conservación del patrimonio artístico y monumental (e.g., localización de áreas industrializadas, protección del tráfico de ciertas áreas, creación de microclimas en monumentos expuestos de especial interés, etc.). Hay que tener en cuenta que los niveles permisibles para la salud humana no tienen porque coincidir con los aplicables a los materiales, que cuando menos, deberían "sufrir" una atmósfera de tipo rural.
3.procesos de Deterioro en ambientes contaminados
3.1.ATAQUE ACIDO
El ataque ácido sobre los materiales pétreos proviene de la presencia en cantidades importantes de gases (generalmente óxidos) contaminantes en la atmósfera. Estos gases se oxidan, reaccionan con el agua atmosférica y se forman ácidos que se encuentran dispersos en forma de aerosoles. Estos aerosoles son la causa del ataque ácido.
Los ácidos más importantes a considerar en relación con el deterioro de los materiales pétreos son el ácido carbónico (H2CO3), formado cuando el CO2 atmosférico se disuelve en agua, el ácido sulfuroso (H2SO3), formado cuando el SO2 se disuelve en agua, el ácido sulfúrico (H2SO4), formado por oxidación del ácido sulfuroso y de SO2, y el ácido nítrico (HNO3), formado por oxidación de óxidos de nitrógeno como NO y NO2. Como veremos a continuación, aún en el caso de existir elevadas concentraciones de gases en la atmósfera, la producción de ácidos en cantidades significativas depende de la presencia de oxidantes y catalizadores efectivos. De hecho, la importancia del ácido nítrico en los procesos de alteración de monumentos no está clara, ya que no existe una relación clara entre las sales de nitrato encontrados en los materiales y los niveles de concentración de óxidos de N en el ambiente. Al menos en parte, esto puede deberse a la existencia o no de catalizadores apropiados.
Otros compuestos polucionantes que pueden adquirir importancia local son los ácidos clohídrico, fluorhídrico y amónico, presentes en áreas con actividad industrial particular.
Estos compuestos agresivos son los que actualmente se consideran como más importantes a la hora de interpretar los mecanismos de alteración de los materiales pétreos. Evidentemente quedan otros (metales pesados, hidrocarburos, óxidos de Fe...), cuyo efecto aplica más a la formación de costras negras o es esencialmente catalítico en las reacciones de formación de ácidos.
3.1.1.Dióxido de Carbono
El dióxido de carbono se encuentra de forma natural en las capas inferiores de la atmósfera en una concentración media de 0.033-0.034 % en volumen. En los últimos decenios el aumento del CO2 en la atmósfera de áreas urbanas ha sido importante (Figura 6), debido a dos causas principales: el ciclo biosférico, como parte de la desintegración orgánica, y la actividad industrial. Esta última causa es la más importante, ya que la combustión del carbón, petróleo y derivados y gas natural para obtener energía libera grandes cantidades de CO2. Entre las distintas fuentes de CO2 industrial, puede destacarse la combustión de gasolina por los coches, que llega a generar el 60 % del total del CO2 emitido de origen industrial (Figura 7).

Figura 6.- Incremento mundial de CO2 debido a la combustión de carburantes fósiles (de Winkler, 1973, Fig. 75).
La combustión de la gasolina produce grandes cantidades de CO2 y NO y NO2 si la combustión es buena, esto es, si la relación aire/gasolina es alta. Si, por el contrario, la combustión no es buena y por lo tanto completa, pueden liberarse cantidades apreciables de CO (monóxido de carbono) y de hidrocarburos no descompuestos (Figura 7). En este último caso, común en ciudades con alto índice de tráfico, la actividad fotoquímica del sol produce la llamada niebla fotoquímica, que consiste en que los hidrocarburos se oxidan, generando óxidos de C y N, y éstos últimos a su vez en ácido carbónico y el altamente corrosivo ácido nítrico.
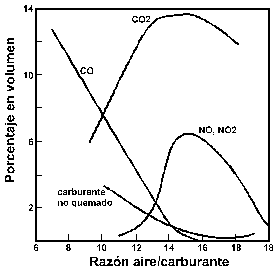
Figura 7.- Cantidades de CO, CO2 y óxidos de N emitidos por la combustión de gasolina (de Winkler, 1973, Fig. 76).
3.1.2.Monóxido de Carbono
La combustión incompleta de carburantes fósiles produce importantes cantidades de monóxido de carbono (CO) anualmente (Figura 7). Es un gas muy tóxico para la vida animal, aunque su acción no es directamente corrosiva sobre el material pétreo. Sin embargo, sirve de catalizador en la oxidación de SO2 a SO3, que sí es nocivo dada su tendencia a oxidarse y formar ácido sulfúrico.
3.1.3.Compuestos de Azufre
La combustión de carburantes naturales, especialmente el carbón, y procesos industriales como el tratamiento de minerales de Fe y Cu como pirita, calcopirita, etc., liberan a la atmósfera grandes cantidades de azufre en forma de anhídrido sulfuroso (SO2). En la atmósfera, el SO2 tiende a oxidarse mediante diversos mecanismos, como reacción en fase gaseosa o líquida, acción catalítica del CO o vapor de agua atmosférico, o mediante la acción fotolítica de la radiación solar. El SO3 por su parte permanece escaso tiempo como tal, debido a su alta higroscopicidad, reaccionando con el agua y transformándose en el ácido sulfúrico (H2SO4), que puede mantenerse en suspensión en la atmósfera bajo la forma de aerosol como gotas de solución acuosa más o menos concentrada.
Es fácil entender que la producción de ácido
sulfúrico a partir de SO3 se ve extremadamente condicionada por la
humedad del aire. Así por ejemplo, la quema de una tonelada de carbón con 1.5 %
de azufre (común en los países industrializados como medida de consumo por
persona y año) libera
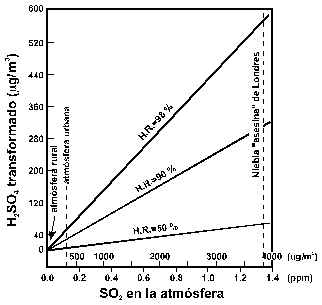
Figura 8.- Conversión de SO2 en ácido sulfúrico en la atmósfera bajo distintas condiciones de humedad relativa (de Winkler, 1973, Fig. 77).
La oxidación del SO2 se realiza mediante diversas y complejas reacciones químicas. Las más importantes cuantitativamente se producen en fase líquida en solución o en finas películas acuosas (e.g., agua adherida a superficies), generando finalmente ácido sulfúrico:
SO2 + H2O
= H2SO3
H2SO3 + 1/2O2 = H2SO4
SO2 + 1/2O2 = SO3
SO3 + H2O = H2SO4
SO2 + H2O2 = H2SO4
SO2 + O3 + H2O = H2SO4 + O2
SO2 +
1/2O2 + H2O = H2SO4 (Fe+3,
Mn+
SO2 + NO2 + H2O = H2SO4 + NO2 (con cataliz)
La oxidación directa del SO2 por el oxígeno atmosférico es muy lenta, aunque la presencia de catalizadores como Fe+3 o Mn+2 puede acelerarla, especialmente en presencia de agua. Además, puede observarse como algunas reacciones involucran al ozono y peróxido de hidrógeno (agua oxigenada). Estos compuestos son especialmente importantes en la generación de ácidos, aunque su pequeña concentración en la atmósfera (en torno a las partes por billón) excluye que tengan un papel predominante. En ambientes con importantes concentraciones de óxidos de N, la última de las reacciones puede ser significativa.
Existen sin embargo en la atmósfera agentes neutralizantes como amoniaco (procedente de procesos naturales de fermentación y ciertas operaciones industriales) y polvo en suspensión (e.g. carbonatos alcalinotérreos). En estas condiciones se forman sulfatos de amonio ((NH)2SO4) y cálcico (CaSO4, CaSO4·2H2O) que permanecen como aerosoles de tipo sólido, lo cual disminuye la acidez del medio, incluso hasta hacerla neutra, según las distintas emisiones a la atmósfera. Así, se ha detectado que en las ciudades polucionadas, la acidez del ambiente presenta un ciclo estacional, siendo ácida en invierno y tendiendo a la neutralidad en verano. Este ciclo puede explicarse por la mayor combustión de carbón en invierno (calefacciones), con el consiguiente aumento del azufre emitido, y la disminución de la actividad biológica a temperaturas más bajas, que reduce la emisión de amoniaco durante la estación fría.
El ataque del ácido sulfúrico a los materiales pétreos de tipo carbonatado (calizas, mármoles) comprende su disolución y la formación de sulfatos y/o sulfitos de Ca y Mg hidratados o no, que por otra parte pueden ser muy solubles en agua. Este proceso sintetiza el grave daño que la lluvia ácida produce a los materiales pétreos carbonatados. El ataque a los materiales silicatados no está muy claro, pero parece ser que realza el proceso de caolinitización (mineral de la arcilla) de los feldespatos.
Una parte del azufre atmosférico se encuentra en el estado gaseoso bajo la forma de ácido sulfhídrico (H2S). Se sabe poco del papel de este ácido, tanto sobre sus posibles procesos de oxidación como de sus variaciones de concentraciones; puede olerse en las cercanías de aguas salmueras contaminadas y con déficit de oxígeno, y se sospecha que puede convertirse en ácido sulfúrico y sulfatos.
En resumen, el azufre atmosférico se encuentra repartido entre componentes gaseosos (SO2, H2S), líquidos (SO4H2) y sólidos (sulfatos de Ca y amoniaco), sin contar con la posible presencia de combinaciones de azufre orgánico o azufre y nitrógeno.
3.1.4.Cloruros
El cloro es un componente importante de la atmósfera. Sus fuentes son naturales (mares, lagos salados) e industriales. En general, los efectos más importantes se observan en las zonas cercanas a las costas, donde se suelen encontrar como productos de alteración de materiales pétreos diferentes cloruros, entre los que destaca el cloruro sódico (halita). El cloro puede convertirse en ácido clorhídrico (HCl), altamente corrosivo sobre materiales carbonatados y metales.
3.1.5.Compuestos de Nitrógeno
Aunque la mayor parte de las sales de nitrógeno encontradas en los materiales pétreos parecen proceder de un origen orgánico directo o por ascenso capilar de aguas subterráneas con importante componente orgánico, no debe excluirse una posible influencia del nitrógeno atmosférico.
El nitrógeno, generalmente como NO2, se encuentra en la atmósfera uniformemente distribuido, en torno a 2-4 microgramos por metro cúbico de aire, si bien en zona industriales y urbanas alcanza valores mucho más altos (e.g. más de 400 microgramos por metro cúbico en Los Angeles). Como se ha indicado más arriba, una de sus fuentes principales es la combustión de gasolina por los automóviles (Figura 7). Los óxidos de nitrógeno pueden convertirse a ácido nítrico (H2NO3), presente como aerosol, a través de la acción fotolítica del sol, constituyendo un ácido fuertemente corrosivo para los materiales pétreos.
3.2.LA COSTRA NEGRA
Es evidente que cualquier superficie expuesta al medio ambiente es susceptible de ser afectada por recubrimientos de las partículas sólidas adherentes presentes en suspensión en el aire. Las superficies toman entonces tonos y coloraciones distintas de las originales, que en general sufrirán un oscurecimiento.
La ubicación de estos depósitos son lugares generalmente protegidos de la acción erosiva de la agua de lluvia, aunque pueden también encontrarse en superficies expuestas a la escorrentía del agua. La causa de esta distribución aleatoria no es conocida, pero se supone que en parte puede deberse a la resistencia y fuerte adhesión al sustrato que algunas costras desarrollan, así como las características de "rugosidad" del material, lo cual les permite crecer incluso en contra de los agentes erosivos.
Los depósitos y costras pueden presentar
grosor, grado de adherencia y morfología muy variadas. En el caso de las
costras propiamente dichas, esto es, de depósitos homogéneos, endurecidos, compactos
y poco porosos, los grosores oscilan entre 0.5 y 2-
La presencia de costras puede asociarse casi sistemáticamente con procesos de deterioro del material pétreo, especialmente con exfoliaciones y desconchamientos, pérdidas de cohesión y presencia de sales (especialmente yeso). Con el tiempo las costras adquieren mas dureza, lo cual incrementa las diferencias fisico-químicas entre la misma y el material pétreo, por lo que los procesos de deterioro aumentan. Por ejemplo, las diferencias de comportamiento térmico son muy acusadas, por lo que l costra tiende a fracturarse y desconcharse, lo cual se acompaña de disgregación y perdida de material pétreo.
Las costras están compuestas por sustancias muy variadas, aunque en su mayor parte son compuestos de carbono (hidrocarburos) producidos por la combustión de carburantes sólidos y a los cuales debe su coloración negra. También se encuentran sistemáticamente cristales de yeso con morfología y tamaño variados, aunque en las costras bien desarrolladas son de tamaños mayores tabulares, aciculares o con formas típicas macladas y en agregados de tipo rosas del desierto. La presencia de estos cristales de yeso da coherencia interna al material, permitiendo la sustentación de las partículas de hidrocarburos. También se encuentran granos de calcita secundarias (neoformadas) micro o criptocristalina, óxidos y compuestos bituminosos de hierro, sales cloradas como halita, granos de cuarzo y otros minerales de origen generalmente eólico y esporas y polen. Generalmente aparecen también oxalatos hidratados de Ca (weddellita, bihidrato, y más comúnmente whewellita, monohidrato), derivados de la actividad metabólica de líquenes y/o de la transformación de aceites o compuestos orgánicos empleados en la antigüedad como protectores o enlucidos de las superficies pétreas. En los casos en que la actividad de aves, especialmente palomas, es importante, pueden encontrarse también fosfatos hidratados de Ca y K. Además, existen cantidades variables de distintos metales pesados (Pb, Mn, Zn, V, Cr, Ni, Cu,...) y algunos compuestos orgánicos de origen dudoso, pero probablemente relacionados con la actividad industrial. (Figura 8 y Tabla 1).
Generalmente las costras están formadas por varias capas estratificadas (apeciables con microscopía óptica en secciones transversales), lo que puede explicarse por acreción de material en suspensión en la atmósfera. La costra no suele adherirse directamente sobre el sustrato rocoso, sino sobre una película de yeso y calcita microcristalina secundaria que corroe al material a lo largo de fracturas y de poros. No es raro encontrar en estas estratigrafías restos mejor o peor conservados de películas pictóricas, enlucidos o de tratamientos antiguos o modernos de protección, pátinas de oxalatos, etc, que deben ser protegidas durante la limpieza del objeto. La estructura de esta capa de puede ser compleja, presentando estratificaciones con morfologías cristalinas variadas (al menos dos, una criptocristalina y otra micocristalina). El grosor de las capas de yeso puede ser muy elevado (varios mm), lo cual acelera el proceso de deterioro al ser acompañada de importante disgregación del material. Además, la eventual pérdida de esta capa por disoluciones ocasionales permite el desconchamiento de la costra, llevándose consigo material y acelerando el proceso al reiniciarse el mismo.
Aunque se conoce relativamente bien la composición y la fuente de los materiales que forman las costras negras, el mecanismo de formación no está muy claro. Parece sin embargo muy probable que su desarrollo tenga mucha relación con su alto contenido en yeso. El yeso de las costras negras puede formarse directamente por ataque ácido sobre el material pétreo, particularmente si éste es carbonatado (CaCO3 + H2SO4 + H20 = CaSO4 2H2O + CO2), puede depositarse sobre las superficies a partir de aerosoles (de hecho se encuentra en las costras negras formadas sobre superficies de rocas silicatadas), y también puede producirse por la acción de sulfobacterias y tiobacterias. En cualquier caso, la costra actúa como reservorio de yeso, cuya presencia acelera la alteración del material pétreo al ejercer de material consolidante de las partículas que se adhieren y favorecer el desarrollo de la costra, por lo que es necesario eliminarla.
Pueden distinguirse dos formas contrastadas de formación de costras negras:
Deposición húmeda:
1) Aire húmedo, cálido y contaminado se pone en contacto con la superficie pétrea, más fría, condensándose el agua en la superficie.
2) La película de agua adherida a la superficie favorece la captura de partículas higroscópicas sólidas dispersas en el aire. Esta captura depende, por tanto, de la diferencia de temperatura entre el muro y el aire.
3) La película de agua reacciona con el SO2 o SO3 atmosféricos en presencia de los oportunos catalizadores adheridos a la superficie y se produce una solución de ácido sulfúrico en contacto con la piedra.
4) La solución ácida reacciona con la piedra y se forma una solución salina sulfatada.
5) Se evapora la solución salina y precipita yeso.
6) La cristalización de yeso consolida las partículas sólidas adheridas, cuyo movimiento se bloquea, y se forma una fina costra endurecida.
7) Nuevo acceso de aire húmedo y contaminado en contacto con la piedra y el ciclo comienza de nuevo.
Deposición seca:
1) Adhesión de partículas dispersas en la atmósfera a la superficie pétrea por atracción electrostática entre cargas no compensadas en las superficies de ambas sustancias.
2) Los enlaces electrostáticos, aún siendo débiles, dan cohesión a la costra.
Mientras las costras formadas por deposición seca crecen en zonas protegidas de la erosión, aquellas formadas por deposición húmeda pueden crecer incluso en zonas sometidas a erosión por escorrentía de agua. Su distribución en las superficies de los edificios es por tanto, relativamente aleatoria, dependiendo de la conductividad térmica, porosidad, grado de saturación en agua, etc. de los materiales pétreos expuestos. Por ejemplo algunas partes del edificio pueden conducir más la temperatura que otras, por lo que durante la noche se enfriarán más y más rápidamente, desarrollándose sobre ellas las costras a pesar de estar expuestas a la acción de lavado del agua.
Para prevenir el desarrollo de costras negras endurecidas debe intervenirse sobre el medio ambiente, ya sea evitando el enfriamiento de las superficies expuestas (efecto parabrisas) ya sea eliminando los niveles de contaminación de los centros históricos.
Última modificación: 13 febrero 2020 16:58