|

Este seminario está pensado para repasar aspectos de cristalquímica
mineral y, sobre todo, ejemplificar las variedades y composiciones de los grupos
de minerales más comunes en rocas metamórficas, así como ilustrar
cualitativamente el efecto de P y T sobre la composición mineral.
Se ofrecen aquí las imágenes discutidas en clase por grupos de
minerales.
Algunas fuentes en internet
MINDAT: https://www.mindat.org/
WEBMINERAL:
http://www.webmineral.com/
Handbook of Mineralogy:
https://handbookofmineralogy.org/
Ver además, nomenclatura y clasificación de minerales
de "International
Mineralogical Association" (IMA),
IMA COMMISSION ON NEW MINERALS, NOMENCLATURE AND CLASSIFICATION. Esta
serie puede obtenerse a través de:
IMA
MAC
MSA
The Mineralogical Society
Haz click aquí para
conseguirlos a través de MSA, algunos de los cuales resalto aquí:
Recent IMA Reports published in the American Mineralogist
Nomenclature of the garnet supergroup, 2013
Edward S. Grew et al. pdf
(2.3 MB)
Nomenclature of the amphibole supergroup, 2012
Frank C. Hawthorne et al. pdf
(4.6 MB)
Named Amphiboles: A new category of amphiboles recognized by the
International Mineralogical Association (IMA) and a defined sequence order for
the use of prefixes in amphibole names, 2005
Ernst A.J. Burke And Bernard E. Leake pdf
(84 KB)
Nomenclature of amphiboles: Additions and revisions to the International
Mineralogical Association's amphibole nomenclature, 2004
Bernard E. Leake et al. pdf
(188 KB)
IMA Reports prior to 1998 published in the Canadian Mineralogist
Robert F. Martin, editor The Canadian Mineralogist, has kindly let the
Mineralogical Society of American host a set of International Mineralogical
Association Commission on New Minerals and Mineral Names reports that were
compiled by the Mineralogical Association of Canada and the Canadian
Mineralogist on the occasion of the IMA 17th General Meeting in Toronto (August
1998). These reports are also available at the Mineralogical
Association of Canada both as an electronic
version and as a Booklet.
On the use of names, prefixes and suffixes, and adjectival modifiers in the
mineralogical nomenclature, 1980
M.H. Hey and G. Gottardi pdf
(176 KB)
The definition of a mineral, 1995
E.H. Nickel pdf
(264 KB)
Formal definitions of type mineral specimens, 1987
P.J. Dunn and J.A. Mandarino pdf
(236 KB)
Solid solutions in mineral nomenclature, 1992
E.H. Nickel pdf
(324 KB)
Nomenclature of the micas, 1998
M. Rieder et al. pdf
(412 KB)
Nomenclature of amphiboles: report of the Subcommittee on Amphiboles of the
International Mineralogical Association, Commission on New Minerals and Mineral
Names, 1997
B.E. Leake et al. pdf
(1.2 MB)
Nomenclature of pyroxenes, 1989
N. Morimoto et al. pdf
(1.5 MB)
Recommended nomenclature for zeolite minerals: report of the Subcommittee on
Zeolites of the International Mineralogical Association, Commission on New
Minerals and Mineral Names, 1997
D.S. Coombs et al. pdf
(340 KB)
Classification and nomenclature of the pyrochlore group, 1977
D.D. Hogarth pdf
(1.0 MB)
Nomenclature of platinum-group-element alloys: review and revision, 1991
D.C. Harris and L.J. Cabr /i pdf
(1.1 MB)
Appendix. Symbols of the rock-forming minerals
After Kretz and Spear pdf
(140 KB)
Para minerales de las arcillas: Bailey, S.W.
(1980) Summary of recommendation of AIPEA nomenclature committee. Clay Minerals,
15, 85-93.
Y
para abreviaturas de
minerales formadores de rocas:
De IMA (pdf).
De Kretz (1983, Am
Min; html editado por mí)
De Donna L. Whitney y Bernard W. Evans (2010; html
editado por mí)
Siivola, J. and Schmid, R., 2007.
Recommendations by the IUGS Subcommission on the Systematics of Metamorphic
Rocks (pdf).
Ver, además:
American Mineralogist
Crystal Structure Database
IMA Mineral List
with Database of Mineral Properties
Introduccion
La unidad básica de todas las estructuras
cristalinas es el átomo (incluyendo el estado ionizado de los mismos o iones,
cargados positivamente -cationes- y negativamente -aniones-). Los átomos de los
elementos que forman los minerales presentan distinto tamaño y estado de
ionización. Estos dos factores condicionan en parte la forma y
propiedades de los minerales. El tamaño de un átomo viene definido por su radio
(en el rango 0.1 - 2 Å; 1 Å = 10-10
m), que depende de:
-
La naturaleza del elemento (estructura
atómica).
-
El estado de ionización o de valencia.
-
El tipo de enlace con el resto de los
átomos.
(descarga de
fichero de Microsoft
Excel con los radios y cargas iónicos)
De entre los distintos tipos de enlaces
interatómicos existentes, la mayor parte de los minerales pueden considerarse
bajo una primera aproximación como estructuras esencialmente iónicas
(aunque presentan también fuerte componente covalente). Por lo tanto, los átomos
de una estructura iónica los podemos visualizar como elementos aislados donde
los cationes tienden a rodearse de aniones y viceversa. El número de iones que
rodean a un ión de carga contraria se denomina número de coordinación,
y depende de la relación de radios efectivos entre ambos o razón radial
(radio catión / radio anión). Dado que este número depende de exigencias
geométricas en una estructura puramente iónica (esto es, considerando los átomos
como esferas rígidas), puede predecirse el número de coordinación de un catión
en función de las razones radiales:

La mayoría de los minerales están constituidos por oxígeno
como principal anión (O2-). Dado que el oxígeno presenta un radio
iónico efectivo de 1.4 Å, mayor que el del resto de los cationes más comunes que
forman los minerales, las estructuras cristalinas que presentan oxígeno pueden
considerarse como empaquetamientos de aniones de oxígeno con los cationes en los
intersticios, como el caso del silicio, rodeado por 4 átomos de oxígeno en los
silicatos. Las coordinaciones de los cationes más importantes (más abundantes)
son:
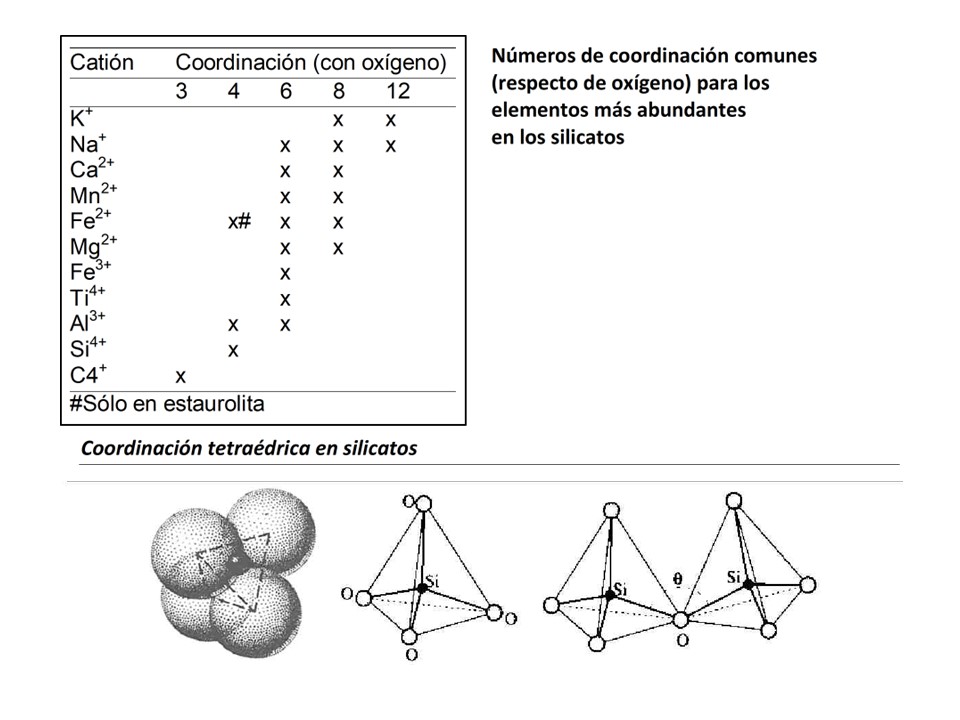
La estabilidad de una estructura
iónica viene determinada esencialmente por condicionamientos geométricos
y de estabilidad electrostática. Los condicionamientos
geométricas resultan, como hemos visto, de la composición elemental y por lo
tanto de los tipos de empaquetamientos de los iones (función de sus radios
iónicos). Los condicionamientos de estabilidad electrostática resultan de la
necesidad de que las cargas positivas y negativas de los iones se neutralicen en
la estructura. Esto significa que en la fórmula mineralógica la
suma de cargas positivas debe ser igual a la suma de cargas negativas. Estos dos
tipos de condicionamientos son los responsables de que el número de minerales (y
por lo tanto de estructuras cristalinas) sea limitado y no muy elevado (en torno
a 4000). Se pueden producir artificialmente compuestos químicos inorgánicos con
cargas balanceadas y estructuras cristalinas y que sin embargo no son posibles
como minerales naturales estables.
La mayoría de los minerales no presentan
composiciones químicas fijas, sino variables entre ciertos rangos
composicionales (i.e. definidas). Esto significa que un mismo mineral puede
presentar composiciones variadas, que en general es función de condicionamientos
fisico-químicos durante su formación. En contra de lo que pudiera pensarse, este
fenómeno es la regla y no la excepción en la naturaleza. Cuando un mineral
presenta esta característica se dice que es una solución sólida.
Esto es debido a la capacidad de sustituciones de unos átomos por otros
de elementos distintos en una estructura determinada, dadas ciertas
exigencias de similitud de tamaño y carga entre ellos.
Por ejemplo, el Ca2+ tiene un
radio de 0.99 Å en la calcita (CO3Ca), y el Mn2+ tiene
0.91 Å en la rodocrosita (CO3Mn); ambos pueden sustituirse mutuamente
en la estructura, constituyendo un mineral que es una solución sólida completa o
continua entre dos límites composicionales (representados por las moléculas de
carbonato de calcio y de manganeso puras). Estos elementos que pueden
sustituirse mutuamente en una estructura determinada se dice que son
intercambiables o diadóquicos. Los límites composicionales entre
los que puede oscilar el mineral (i.e., CO3Ca y CO3Mn) se
denominan términos extremos. En estos casos, la fórmula del
mineral solución sólida se expresa como CO3(Ca,Mn), significando el
paréntesis junto con la coma que los átomos de Ca2+ y los de Mn2+
deben sumar 1; una composición posible intermedia sería CO3(Ca0.75Mn0.25).
Otro ejemplo es el olivino, cuya composición oscila entre Fe2[SiO4]
(Fayalita) y Mg2[SiO4] (Forsterita), formulándose como (Fe,Mg)2[SiO4]
y aplicándole el mismo tipo de razonamiento que en el caso de los carbonatos
visto anteriormente (i.e., Fe+Mg=2).
Cuando los radios atómicos de los elementos
no son tan similares, la sustitución puede no ser total sino parcial. Así,
siguiendo con el mismo ejemplo de los carbonatos, el Mg2+ tiene un
radio de 0.66 Å en la magnesita (CO3Mg), sin embargo no pueden
existir minerales de cualquier composición entre los términos extremos CO3Ca
y CO3Mg, sino calcita con cierta proporción de Mg y magnesita con
cierta proporción de Ca. Esto es debido a que las distorsiones que se introducen
en las estructuras de los minerales puros al darse las sustituciones de los
cationes con distinto radio llegan ser tales, que la estructura resultante de
una sustitución muy extensiva es inestable. En estos casos de soluciones
sólidas parciales los elementos no son perfectamente diadóquicos o
intercambiables.
Las sustituciones pueden ser muy complejas.
No es necesario que cationes con igual radio y carga se sustituyan, sino que se
pueden dar sustituciones más complejas que en conjunto supongan neutralidad de
carga en la fórmula y distorsiones de la estructura no muy grandes. Por ejemplo,
las plagioclasas constituyen una solución sólida continua (a alta temperatura)
entre los términos extremos NaAlSi3O8 (Albita) y CaAl2Si2O8
(Anortita). Puede observarse que la sustitución no puede ser únicamente Na+1
por Ca+2 ya que no se mantendría el balance de cargas. La
sustitución es múltiple o acoplada, implicando al mismo
tiempo al Al+3 y Si+4 de manera que finalmente se
mantienen la exigencia de estabilidad eléctrica: (Ca+2 Al+3)
® (Na+1 Si+4). Un
caso concreto sería Na0.8Ca0.2Al1.2Si2.8O8.
La fórmula genérica de las plagioclasas podría escribirse como (Na,Ca)Al(Al,Si)Si2O8,
que especifica mucho más claramente la sustitución múltiple.
Aunque este tipo de sustituciones permite
introducir en las estructuras cationes de cargas diferentes, hay que señalar que
no todas las sustituciones entre cualesquiera elementos son posibles. En primer
lugar, los radios de los elementos deben ser similares, y además, las
diferencias de carga no deben ser grandes (en general menor o igual a 2).
Sin entrar en detalles, se puede decir que
el grado de sustitución en soluciones sólidas parciales es función de la
temperatura de formación del mineral. A altas temperaturas el grado de
sustitución es mayor porque las estructuras se "dilatan", permitiendo
mayores diferencias en los tamaños de los átomos intercambiados. En éste
sentido, los minerales solución sólida se comportan como las soluciones acuosas
de sales: a mayor temperatura, aumenta la capacidad de disolver más cantidad de
sales por parte del agua. Además, a veces los minerales que a altas temperaturas
pueden formar soluciones sólidas completas o más extensas, al bajar la
temperatura pueden no comportarse igual, exsolviéndose en dos fases minerales de
composición distinta. Por ejemplo, los feldespatos alcalinos pueden formar
solución sólida completa entre los términos extremos KAlSi3O8
(Ortosa) y NaAlSi3O8 (Albita) a altas temperaturas (más de
800-900 ºC). El mineral resultante sería (K,Na)AlSi3O8.
Sin embargo, al enfriarse (lentamente), la solución sólida no puede ser
completa, y se forman en el mismo grano mineral dos feldespatos distintos, uno
rico en K con cierta proporción de Na (ortosa), y otro rico en Na con cierta
proporción en K (albita). Se dice entonces que el mineral se ha exsuelto.
Fórmulas minerales
Tomadas de la base de datos termodinámicos de
Holland y Powell
(1998):
Ortho & Ring Silicates
|
|
forsterite |
fo |
Mg2SiO4 |
|
fayalite |
fa |
Fe2SiO4 |
|
tephroite |
teph |
Mn2SiO4 |
|
larnite-bredigite |
lrn |
Ca2SiO4 |
|
monticellite |
mont |
CaMgSiO4 |
|
clinohumite |
chum |
Mg9Si4O18H2 |
|
pyrope |
py |
Mg3Al2Si3O12 |
|
almandine |
alm |
Fe3Al2Si3O12 |
|
spessartine |
spss |
Mn3Al2Si3O12 |
|
grossular |
gr |
Ca3Al2Si3O12 |
|
andradite |
andr |
Ca3Fe2Si3O12 |
|
osumilite(1) |
osm1 |
KMg2Al5Si10O30 |
|
osumilite(2) |
osm2 |
KMg3Al3Si11O30 |
|
Fe-osumilite |
fosm |
KFe2Al5Si10O30 |
|
vesuvianite |
vsv |
Ca19Mg2Al11Si18O78H9 |
|
andalusite |
and |
Al2SiO5 |
|
kyanite |
ky |
Al2SiO5 |
|
sillimanite |
sill |
Al2SiO5 |
|
hydroxy-topaz |
tpz |
Al2SiO6H2 |
|
Mg-staurolite |
mst |
Mg4Al18Si7.5O48H4 |
|
Fe-staurolite |
fst |
Fe4Al18Si7.5O48H4 |
|
Mn-staurolite |
mnst |
Mn4Al18Si7.5O48H4 |
|
Mg-chloritoid |
mctd |
MgAl2SiO7H2 |
|
Fe-chloritoid |
fctd |
FeAl2SiO7H2 |
|
Mn-chloritoid |
mnctd |
MnAl2SiO7H2 |
|
merwinite |
merw |
Ca3MgSi2O8 |
|
spurrite |
spu |
Ca5Si2O11C |
|
zoisite |
zo |
Ca2Al3Si3O13H |
|
clinozoisite |
cz |
Ca2Al3Si3O13H |
|
Fe-epidote |
fep |
Ca2Fe2AlSi3O13H |
|
epidote |
ep |
Ca2FeAl2Si3O13H |
|
lawsonite |
law |
CaAl2Si2O10H4 |
|
pumpellyite |
pump |
Ca4MgAl5Si6O28H7 |
|
gehlenite |
geh |
Ca2Al2SiO7 |
|
akermanite |
ak |
Ca2MgSi2O7 |
|
rankinite |
rnk |
Ca3Si2O7 |
|
tilleyite |
ty |
Ca5Si2O13C2 |
|
cordierite |
crd |
Mg2Al4Si5O18 |
|
hydrous cordierite |
hcrd |
Mg2Al4Si5O19H2 |
|
Fe-cordierite |
fcrd |
Fe2Al4Si5O18 |
|
Mn-cordierite |
mncrd |
Mn2Al4Si5O18 |
|
Phase A |
phA |
Mg7Si2O14H6 |
|
sphene |
sph |
CaTiSiO5 |
|
zircon |
zrc |
ZrSiO4 |
Chain
Silicates
|
|
enstatite |
en |
Mg2Si2O6 |
|
ferrosilite |
fs |
Fe2Si2O6 |
|
Mg-Ts pyroxene |
mgts |
MgAl2SiO6 |
|
diopside |
di |
CaMgSi2O6 |
|
hedenbergite |
hed |
CaFeSi2O6 |
|
jadeite |
jd |
NaAlSi2O6 |
|
acmite |
acm |
NaFeSi2O6 |
|
Ca-Ts
pyroxene |
cats |
CaAl2SiO6 |
|
rhodonite |
rhod |
MnSiO3 |
|
pyroxmangite |
pxmn |
MnSiO3 |
|
wollastonite |
wo |
CaSiO3 |
|
pseudowollastonite |
pswo |
CaSiO3 |
|
tremolite |
tr |
Ca2Mg5Si8O24H2 |
|
ferroactinolite |
fact |
Ca2Fe5Si8O24H2 |
|
tschermakite |
ts |
Ca2Mg3Al4Si6O24H2 |
|
pargasite |
parg |
NaCa2Mg4Al3Si6O24H2 |
|
glaucophane |
gl |
Na2Mg3Al2Si8O24H2 |
|
Fe-glaucophane |
fgl |
Na2Fe3Al2Si8O24H2 |
|
riebeckite |
rieb |
Na2Fe5Si8O24H2 |
|
anthophyllite |
anth |
Mg7Si8O24H2 |
|
Fe-anthophyllite |
fanth |
Fe7Si8O24H2 |
|
cummingtonite |
cumm |
Mg7Si8O24H2 |
|
grunerite |
grun |
Fe7Si8O24H2 |
|
gedrite |
ged |
Mg5Al4Si6O24H2 |
|
sapphirine (442) |
spr4 |
Mg4Al8Si2O20 |
|
sapphirine (793) |
spr7 |
Mg3.5Al9Si1.5O20 |
|
Fe-sapphirine |
fspr |
Fe3.5Al9Si1.5O20 |
|
Mg-carpholite |
mcar |
MgAl2Si2O10H4 |
|
Fe-carpholite |
fcar |
FeAl2Si2O10H4 |
|
Deerite |
deer |
Fe18Si12O50H10 |
Sheet
Silicates
|
|
muscovite |
mu |
KAl3Si3O12H2 |
|
celadonite |
cel |
KMgAlSi4O12H2 |
|
Fe-celadonite |
fcel |
KFeAlSi4O12H2 |
|
paragonite |
pa |
NaAl3Si3O12H2 |
|
margarite |
ma |
CaAl4Si2O12H2 |
|
phlogopite |
phl |
KMg3AlSi3O12H2 |
|
annite |
ann |
KFe3AlSi3O12H2 |
|
Mn-biotite |
mnbi |
KMn3AlSi3O12H2 |
|
eastonite |
east |
KMg2Al3Si2O12H2 |
|
Na-phlogopite |
naph |
NaMg3AlSi3O12H2 |
|
clinochlore |
clin |
Mg5Al2Si3O18H8 |
|
amesite |
ames |
Mg4Al4Si2O18H8 |
|
Al-free chlorite |
afchl |
Mg6Si4O18H8 |
|
Daphnite |
daph |
Fe5Al2Si3O18H8 |
|
Mn-chlorite |
mnchl |
Mn5Al2Si3O18H8 |
|
sudoite |
sud |
Mg2Al4Si3O18H8 |
|
Fe-sudoite |
fsud |
Fe2Al4Si3O18H8 |
|
pyrophyllite |
prl |
Al2Si4O12H2 |
|
talc |
ta |
Mg3Si4O12H2 |
|
Fe-talc |
fta |
Fe3Si4O12H2 |
|
tschermak-talc |
tats |
Mg2Al2Si3O12H2 |
|
kaolinite |
kao |
Al2Si2O9H4 |
|
prehnite |
pre |
Ca2Al2Si3O12H2 |
|
chrysotile |
chr |
Mg3Si2O9H4 |
|
antigorite |
atg |
Mg48Si34O147H62 |
Framework
Silicates
|
|
albite |
ab |
NaAlSi3O8 |
|
high albite |
abh |
NaAlSi3O8 |
|
microcline |
mic |
KAlSi3O8 |
|
sanidine |
san |
KAlSi3O8 |
|
anorthite |
an |
CaAl2Si2O8 |
|
quartz |
q |
SiO2 |
|
tridymite |
trd |
SiO2 |
|
cristobalite |
crst |
SiO2 |
|
coesite |
coe |
SiO2 |
|
stishovite |
stv |
SiO2 |
|
nepheline |
ne |
NaAlSiO4 |
|
kalsilite |
kals |
KAlSiO4 |
|
leucite |
lc |
KAlSi2O6 |
|
meionite |
me |
Ca4Al6Si6O27C |
|
wairakite |
wrk |
CaAl2Si4O14H4 |
|
laumontite |
lmt |
CaAl2Si4O16H8 |
|
heulandite |
heu |
CaAl2Si7O24H12 |
|
stilbite |
stlb |
CaAl2Si7O25H14 |
|
analcite |
anl |
NaAlSi2O7H2 |
Oxides & Hydroxides
|
|
lime |
lime |
CaO |
|
rutile |
ru |
TiO2 |
|
periclase |
per |
MgO |
|
manganosite |
mang |
MnO |
|
corundum |
cor |
Al2O3 |
|
hematite |
hem |
Fe2O3 |
|
nickel oxide |
NiO |
NiO |
|
pyrophanite |
pnt |
MnTiO3 |
|
geikielite |
geik |
MgTiO3 |
|
ilmenite |
ilm |
FeTiO3 |
|
baddeleyite |
bdy |
ZrO2 |
|
spinel |
sp |
MgAl2O4 |
|
hercynite |
herc |
FeAl2O4 |
|
magnetite |
mt |
Fe3O4 |
|
magnesioferrite |
mft |
Fe2MgO4 |
|
ulvospinel |
usp |
Fe2TiO4 |
|
brucite |
br |
MgO2H2 |
|
diaspore |
dsp |
AlO2H |
|
goethite |
gth |
FeO2H |
Carbonates
|
|
calcite |
cc |
CaCO3 |
|
aragonite |
arag |
CaCO3 |
|
magnesite |
mag |
MgCO3 |
|
siderite |
sid |
FeCO3 |
|
rhodochrosite |
rhc |
MnCO3 |
|
dolomite |
dol |
CaMg(CO3)2 |
|
ankerite |
ank |
CaFe(CO3)2 |
Ir a la cabecera de la página
Efecto de P y T
Cuando una especie química existe con más de
un tipo de estructura se dice que presenta polimorfismo. Por
ejemplo, el carbonato de calcio (CO3Ca) presenta dos polimorfos, la
calcita que es trigonal y el aragonito que es ortorrómbico. Otro ejemplo es el
óxido de silicio (SiO2), que presenta un número elevado de
polimorfos, como el cuarzo (cuarzo-a,
cuarzo-b), coesita, cristobalita, tridimita,
etc. Esto es debido a que la estructura de un compuesto no es sólo función de la
composición química del mismo, sino que también lo es de las condiciones fisico-químicas
de formación (esencialmente presión y temperatura).
De estas consideraciones tenemos dos
corolarios interesantes:
-
Una estructura determinada es indicativa
de ciertas condiciones de formación.
-
Un mineral con una estructura puede
cambiar a otra en estado sólido si las condiciones cambian y son apropiadas
para el cambio.
Así, siguiendo con el ejemplo anterior, el
aragonito es el polimorfo de alta presión y la calcita de baja presión: si el CO3Ca
se forma a alta presión se producirá aragonito, y si las condiciones de presión
disminuyen, el mineral anterior se invertirá a calcita. El aragonito no es
estable en la superficie terrestre, y sin embargo se encuentra. Esto es debido a
que se puede conservar como tal si la presión descendió rápidamente, no
permitiéndose la inversión a calcita, o a que bajo ciertas circunstancias puede
formarse fuera de su campo de estabilidad (i.e. a baja P) de manera inestable.
Esto mismo le ocurre a muchos tipos de minerales. Así, el cuarzo pasa de cuarzo-a
a cuarzo-b cuando se superan unos 573
ºC a 1 atmósfera de presión. A medida que la presión es mayor, la transición se
verifica a mayor temperatura (pendiente dP/dT positiva, como la mayoría de las
reacciones metamórficas). Existenotros polimorfos de SiO2 (cristobalita,
tridimita, stishovita,...) estables a distintas condiciones P-T, pero son de
escaso interés en Petrología Metamórfica ya que sus campos de estabilidad
superan los límites de temperatura o presión normales para el metamorfismo.
Quizás el único que interesa es coesita, típico de ambientes de
ultra-alta-presión, siendo su campo de estabilidad 27-29 kbar para temperaturas
entre 400-800 ºC.
A lo largo de una curva P-T de transición polimórfica
coexisten dos polimorfos. Esta curva tiene varianza termodinánica = 1, como
vemos aplicando la regla de las fases (Componentes+2=Fases+varianza): varianza
[= 1 (componentes: SiO2) + 2 - 2 (fases: cuarzo-a
y cuarzo-b)] = 1. Esto significa que
fijando una variable cualquiera (P ó T), la otra variable queda determinada.
Pero, si una sustancia puede conformarse con más de dos polimorfos, entonces
existen puntos en el espacio P-T donde coexisten tres polimorfos. En el ejemplo
anterior, el punto P-T donde coexisten cuarzo-a, cuarzo-b
y coesita está fuera del diagrama. Pero un ejemplo clásico es el punto triple de
los polimorfos de los silicatos de Al (distena, sillimanita, andalucita),
abundantes en rocas pelíticas metamorfizadas. En este caso, la varianza del
punto P-T es = 0 (= 1 + 2 - 3; téngase en cuenta que el número de componentes
del sistema es = 1, SiAl2O5,
y no 2, SiO2 y Al2O3, ya que los componentes de
la Regla de las Fases debe ser "el número mínimo de componentes
químicos que describen el sistema"; dado que las tres fases tiene la misma proporción
molar de SiO2 y Al2O3, 1:1, y que esta
proporción no puede cambiar por necesidades estructurales en ninguna de las fases, el sistema queda
perfectamente descrito por un solo componente, Al2SiO5).
Por otro lado, estamos considerando el efecto P-T sobre
sustancias puras. Pero puede darse el caso que no lo fuesen, sino que una o más
fases fases admitan componentes químicos en cantidad variable (soluciones sólidas).
En este caso, las varianzas termodinámicas de las transiciones polimórficas
cambian. Veámoslo con un ejemplo sencillo. Un componente que suele estar diluido
en los polimorfos de los silicatos de Al, es el manganeso. El número de
componentes que ahora describe el sistema, obviamente, no es 1. El Mn entra en
la estructura de los polimorfos de los silicatos de Al como Mn3+
sustituyendo al Al, dados los requerimientos de estabilidad electroestática. Por
ello, la solución sólida varia entre los términos extremos Al2SiO5
y Mn2SiO5, y el número de componentes que describen el
sistema es, por tanto, = 2 (de nuevo, no es 3: SiO2, Al2O3,
Mn2O3, ya que el SiO2 no puede variar de forma
independiente). Por ello, las transiciones entre dos y tres polimorfos tendrán
varianza = 2 (divariante: = 2 + 2 - 2) y = 1 (univariante: 2 + 2 - 3),
respectivamente. Por ejemplo, la transición entre andalucita y sillimanita es
divariante, y ocupa un espacio dado en el campo P-T. La transición distena-sillimanita-andalucita
es univariante, y ocupa un curva en el espacio P-T, como se ilustra en la figura
siguiente. Por simplicidad, en esta figura se asume las cantidades de Mn2SiO5
en distena y sillimanita son = 0, y que sólo la andalucita es una solución
sólida entre los términos extremos Al2SiO5
y Mn2SiO5. Esta
suposición está justificada por el hecho de que es la andalucita el mineral que,
con diferencia, admite más Mn en su estructura (de hecho, esta es la razón de su
pleocroismo rosado). En este caso, la curva que describe la transición
univariante distena-sillimanita-andalucita coincide con la transición
univariante distena-sillimanita en el subsistema Al2SiO5
(sin Mn).
Como puede apreciarse en la figura, al aumentar la cantidad de
Mn2SiO5 en la andalucita (XMnAnd = XMn2SiO5And)
el campo de estabilidad de la andalucita aumenta, tanto en temperatura como en
presión. El aumento del campo de estabilidad es notable en la parte de alta
temperatura (transición polimórfica andalucita = sillimanita). Por tanto, es
posible tener andalucita estable a alta temperatura si esta fase contiene Mn3+.
Dicho de otra manera, a alta temperatura, la andalucita sólo es posible si
contiene Mn3+. O dicho de otra manera, a medida que aumenta la
temperatura aumenta la cantidad de Mn3+ en la andalucita. El efecto
de la presión es cualitativamente similar.
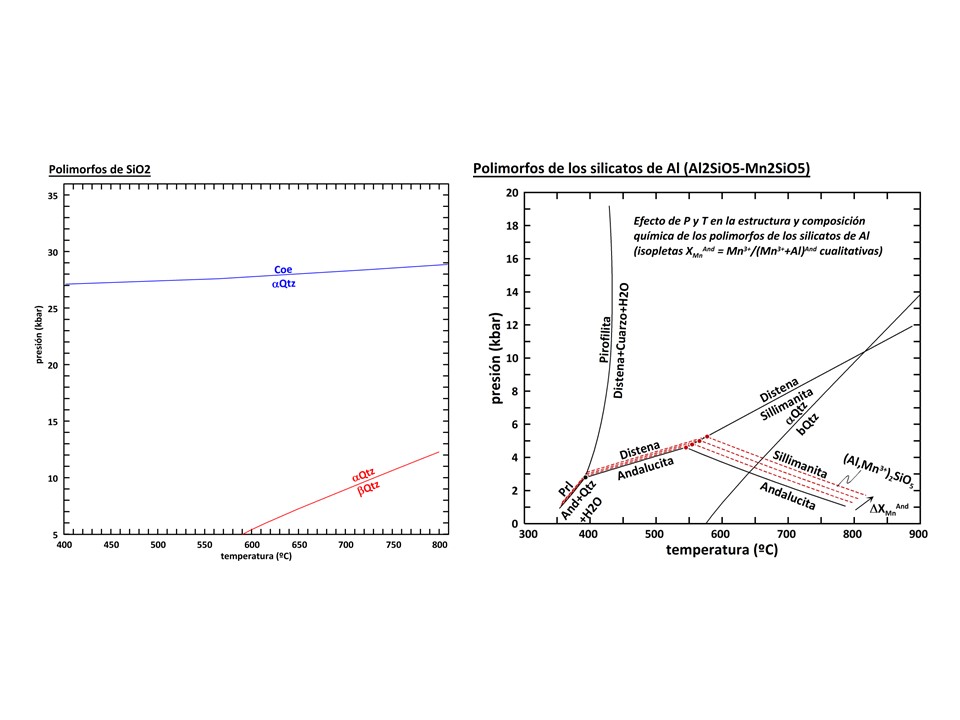
En el diagrama anterior también se ha
representado el límite inferior de estabilidad de la asociación silicato de Al (distena
ó andalucita) + cuarzo + fluido H2O, o dicho de otra forma, el límite superior
de estabilidad de pirofilita (Prl). La reacción no está balanceada (no contiene
coeficientes estequiométricos), lo cual es un procedimeinto normal en libros de
texto ya que para balancear una reacción es necesario definir las fórmulas de
las fases implicadas. Considerando la fórmula de pirofilita como Al4Si8O20(OH)4,
silicato de Al Al2SiO5, cuarzo SiO2 y fluido H2O,
la estequimetría sería 1 Prl = 2 Als + 6 Qtz + 2 H2O.
Para la asociación de las cinco fases
cuarzo, distena, andalucita, pirofilita, fluido, el número de componentes del
sistema es 3: SiO2, Al2O3,
H2O, y la varianza es por tanto = 0 (invariante). Esta asociación se
representa en el espacio P-T por un punto (negro en la figura). Para la
asociación de las cuatro fases cuarzo, distena, pirofilita y fluido, el
número de componentes del sistema es también 3: SiO2, Al2O3,
H2O, por lo que la varianza de la asociación es = 1 (univariante).
Esta asociación univariante se representa en el espacio P-T por una curva que
corresponde al ejemplo clásico de reacción química. Lo mismo puede decirse de la
asociación de cuatro fases cuarzo, andalucita, pirofilita y fluido. Las
dos reacciones univariantes intersectan en el punto invariante. También en este
punto intersecta la asociación univariante distena + andalucita (reacción de
transición polimórfica).
Si consideramos, además el componente Mn2O3
(ahora, número de componentes = 4) y asumimos que sólo la andalucita puede
contener este componente, la reacción que describe la asociación de cuatro fases
cuarzo, andalucita, pirofilita y fluido, pasa ahora a ser divariante, ocupando
una región en el espacio P-T, como se ilustra por las líneas rojas discontinuas
en la figura. No obstante, la reacción que describe la asociación de cuatro
fases cuarzo, distena, pirofilita y fluido, sigue siendo univariante ya que
asumimos que ninguna fase admite Mn2O3, por lo que este
componente no es necesario y el número de componentes sería por tanto = 3. Esta
reacción univariante coincide en el espacio P-T con la reacción univariante que
describe la asociación de cinco fases cuarzo, distena, andalucita,
pirofilita y fluido.
Como vemos en la figura, la figura el campo de
estabilidad de andalucita + cuarzo + H2O (¡no de andalucita a secas!) se expande
hacia temperaturas más bajas a medida que la andalucita contenga más Mn3+.
Dicho de otra manera, si andalucita coexiste con cuarzo y H2O, es posible que
sea estable a baja T si contiene Mn3+.
Con este ejemplo se ilustra que el efecto
cualitativo y cuantitativo de P-T sobre la composición de una fase dada NO
DEPENDE SÓLO DE P-T, sino que también depende de la asociación mineral que
coexista con la fase dada. No obstante, es común que una fase dada,
independientemente de la asociación con la que coexista, cambie de composición
en un sentido dado a medida que cambia T o P. Por ejemplo, a medida que aumenta
T el anfíbol cálcico tiene a ser más tschermakítico y edenítico (más pargasítico)
y a medida que aumenta P tiende a ser más rico en componente glaucofana (barroisítico
- winchítico). Otro ejemplo, las micas tiene a admitir más titanio a medida que
aumenta T, y la moscovita tiene más componente celadonítico (fengítica) a medida
que aumenta P. Otros minerales tienen también tendencias claras a medida que
cambian P y/o T, pero todos ellos pueden describirse de así sólo de forma
cualitativa.
Y más aún, a veces no es posible establecer
ni siquiera cualitativamente el efecto P-T sobre la composición de una fase. Por
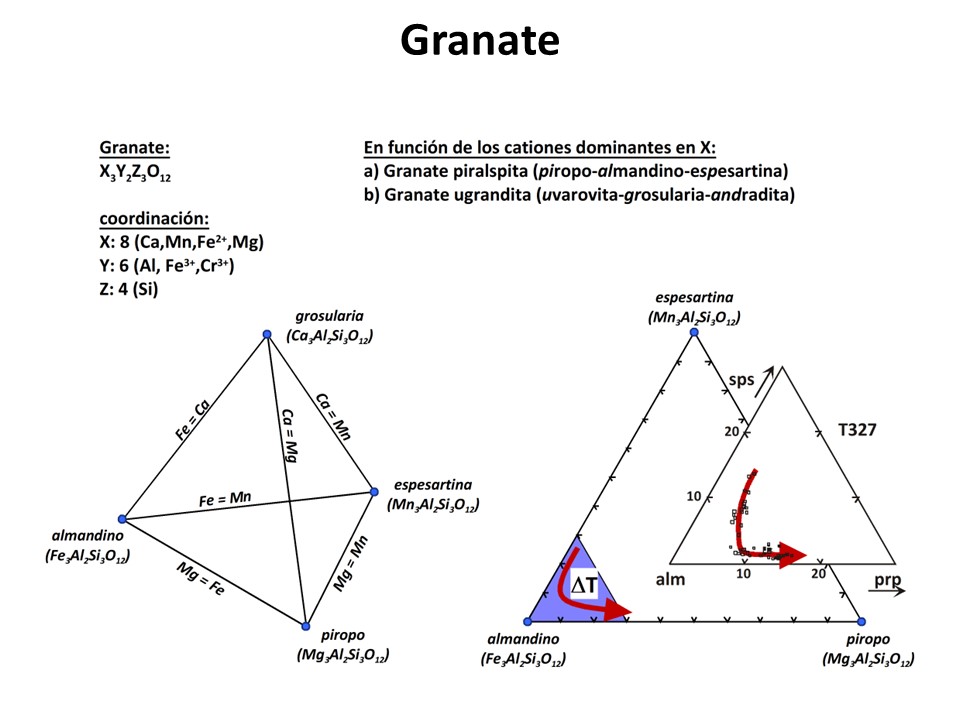
ejemplo, el granate suele aumentar en Mg (piropo), disminuir en Mn (espesartina)
y aumentar en Mg# (Mg/[Fe2++Mg]) a medida que aumenta la temperatura,
pero nada puede decirse del Ca (grossularia). Todo depende de las fases con las
que coexista. En metapelitas con silicatos de Al, la grosularia suele aumentar
al aumentar la presión, pero esto no es necesariamente así en metabasitas
(anfibolitas, esquistos azules, eclogitas).
Lo que veremos en este seminario son los
espectros composicionales comunes de las fases minerales de interés en rocas
metamórficas, sus términos extremos significativos, y las tendencias comunes,
sin entrar en detalles sobre cambios cuantitativos.
Granate
2013 IMA
Report: Nomenclature of the garnet supergroup. Edward S. Grew (Chair),
Andrew J. Locock, Stuart J. Mills (Vice-Chair), Irina O. Galuskina, Evgeny V.
Galuskin, and Ulf Hålenius.
Full Text (2.3 MB).
Deposit Item


Ir a la cabecera de la página
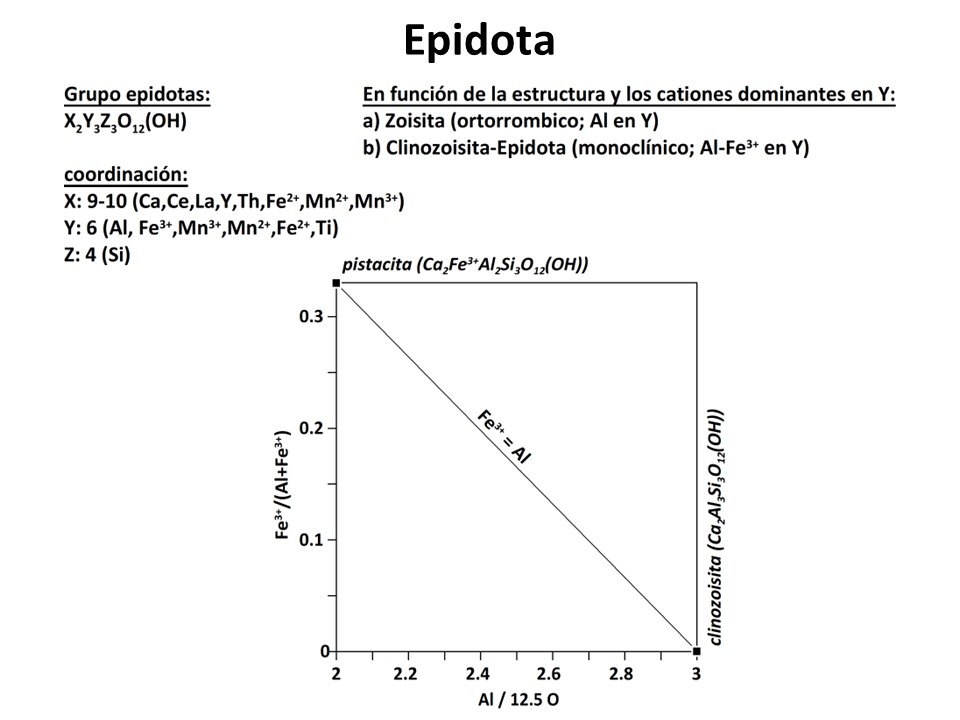
Epidota
IMA Nomenclature (Epidote group): Armbruster, T. et al.,. 2006: European Journal of Mineralogy, 18,
551–567
Mira también: MinDat.org:
http://www.mindat.org/min-6662.html
Handbook of Mineralogy
Zoisite:
https://rruff.geo.arizona.edu/doclib/hom/zoisite.pdf
Clinozoisite:
https://rruff.geo.arizona.edu/doclib/hom/clinozoisite.pdf
Epidote:
https://rruff.geo.arizona.edu/doclib/hom/epidote.pdf
Ir a la cabecera de la página
Clorita
Ver: Bailey, S.W. (1980)
Summary of recommendation of AIPEA
nomenclature committee. Clay Minerals., 15, 85-93.

Ir a la cabecera de la página
Piroxenos
Nomenclature of pyroxenes, 1989. N. Morimoto et al. pdf
Can Miner, o pdf
Am Miner
Ver también "The recalculation of pyroxene end-member parameters and the estimation of ferrous and ferric iron content from electron microprobe analyses"
1974.
R. Grant Cawthorn & Kenneth D. Collerson:
pdf

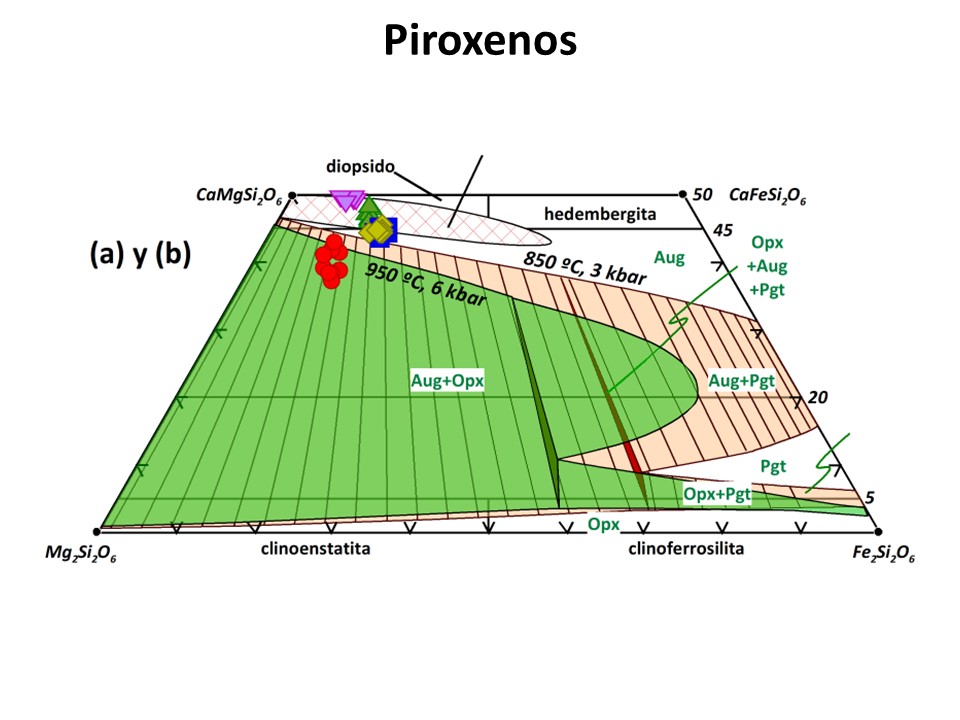

Ir a la cabecera de la página
Anfíboles
Nomenclature of the amphibole supergroup, 2012
Frank C. Hawthorne et al. pdf (4.6 MB)
Named Amphiboles: A new category of amphiboles recognized by the International Mineralogical Association (IMA) and a defined sequence order for the use of prefixes in amphibole names, 2005
Ernst A.J. Burke And Bernard E. Leake pdf (84 KB)
Nomenclature of amphiboles: Additions and revisions to the International Mineralogical Association's amphibole nomenclature, 2004
Bernard E. Leake et al. pdf (188 KB)
Nomenclature of amphiboles: report of the Subcommittee on Amphiboles of the International Mineralogical Association, Commission on New Minerals and Mineral Names, 1997
B.E. Leake et al. pdf (1.2 MB)
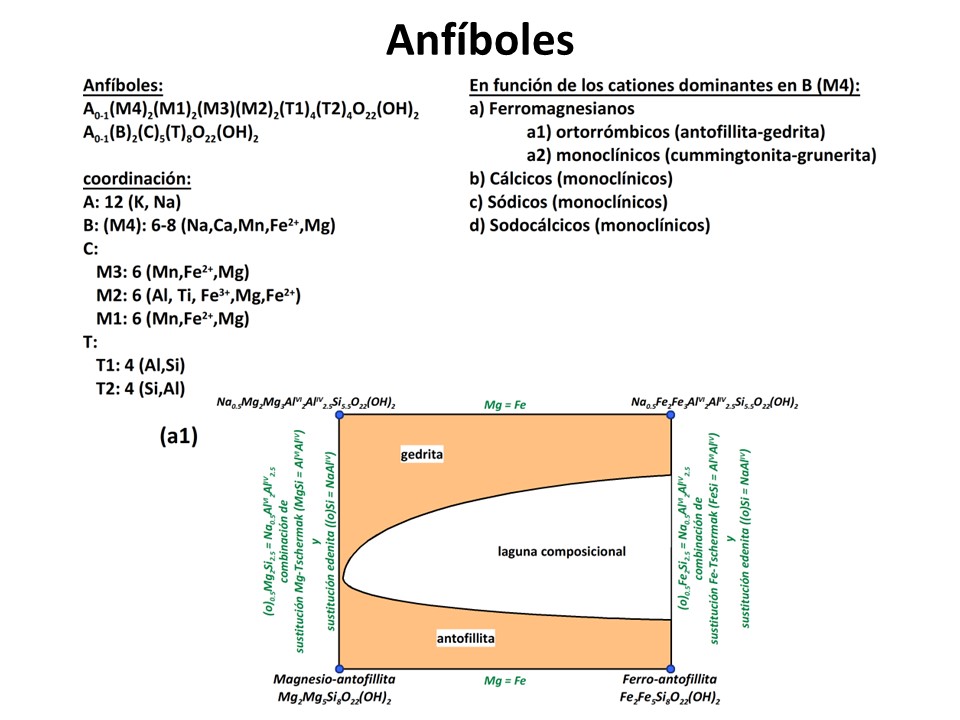
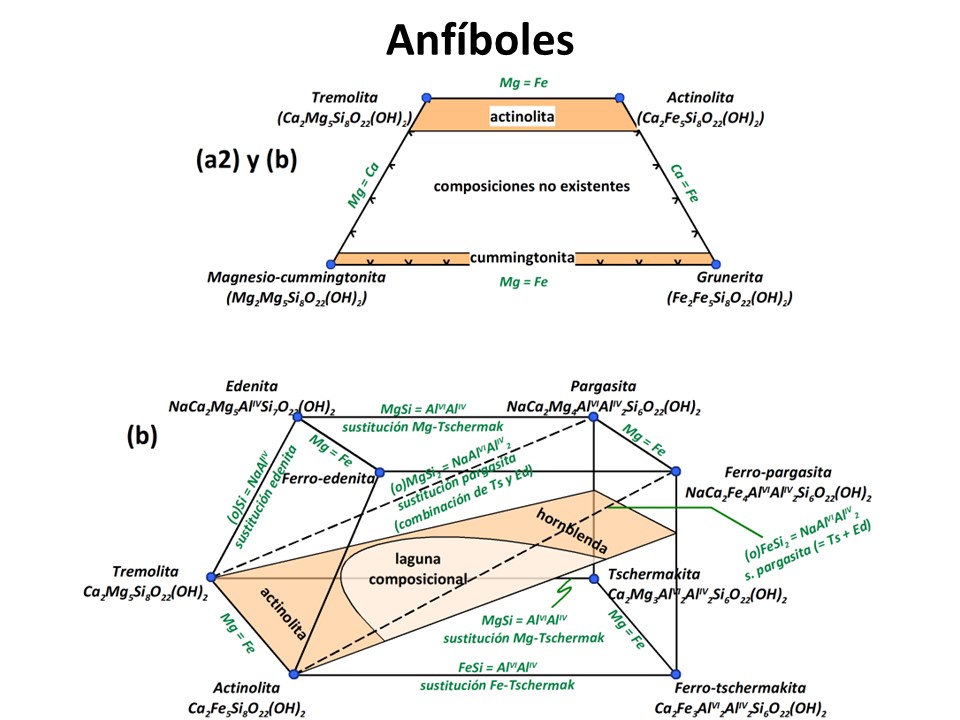
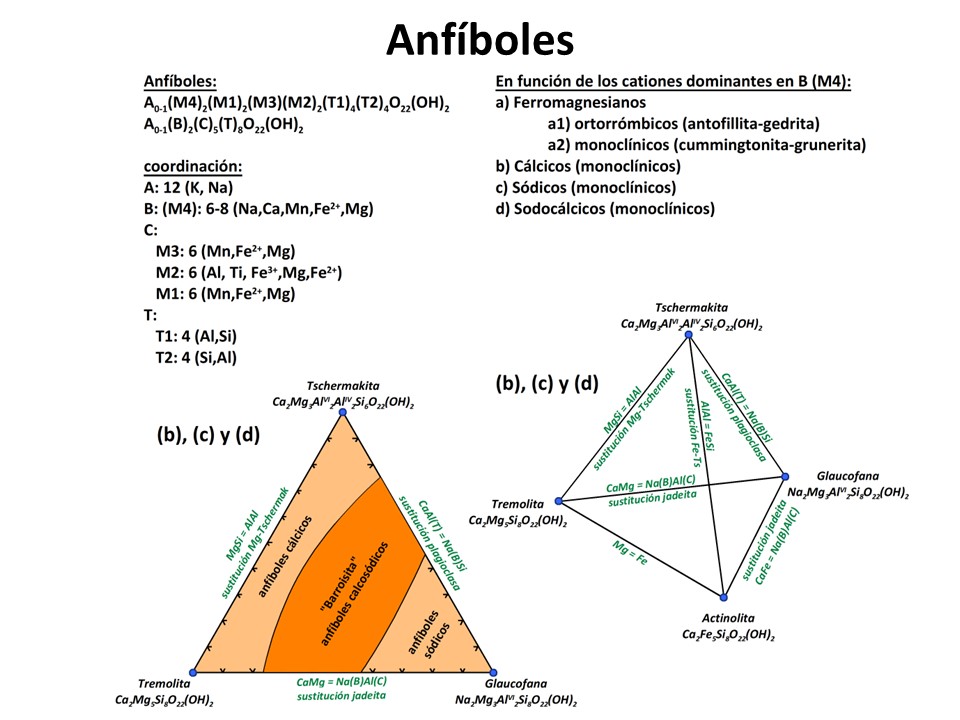

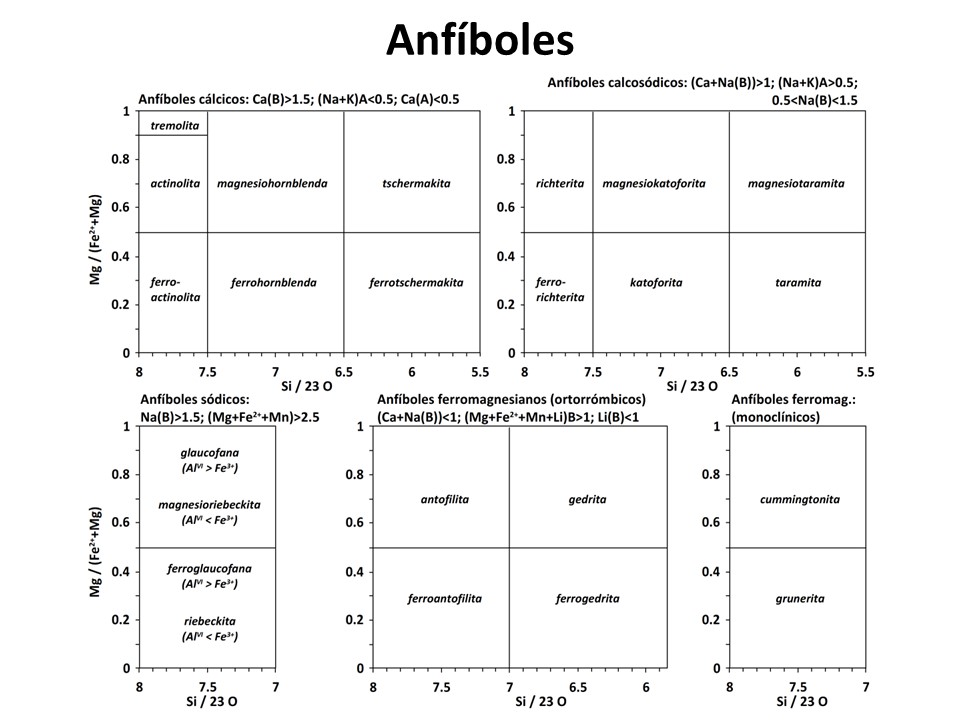
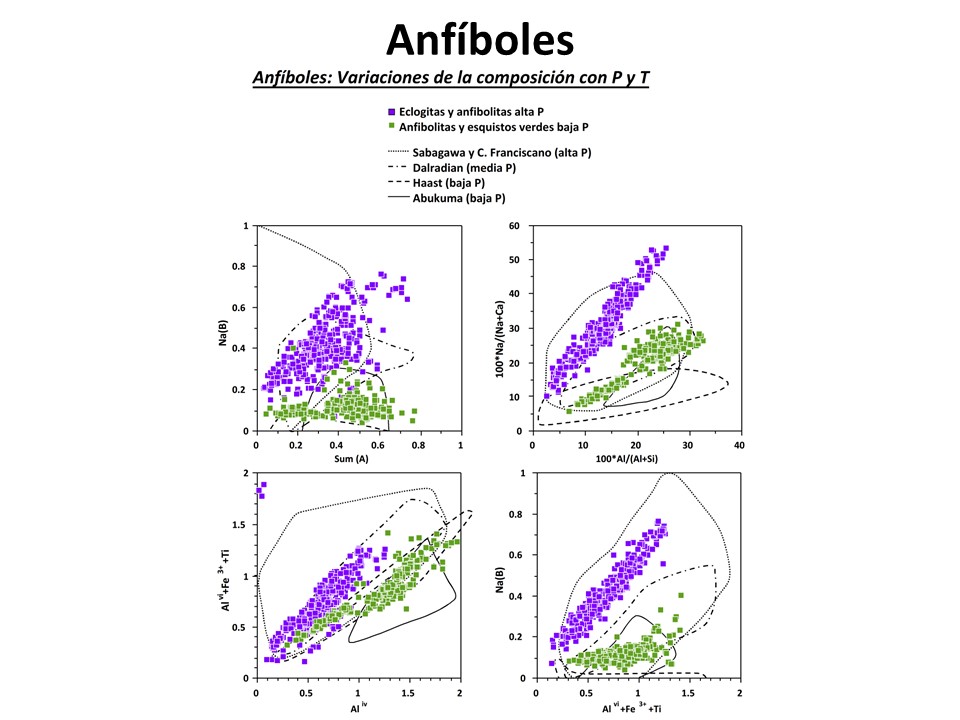
Laird, Jo and Albee, Arden L. (1981) Pressure, Temperature, and Time Indicators in Mafic Schist: Their Application to Reconstructing the Polymetamorphic History of Vermont. American Journal of Science,
281 (2), 127-175. doi:10.2475/ajs.281.2.127.
Ir a la cabecera de la página
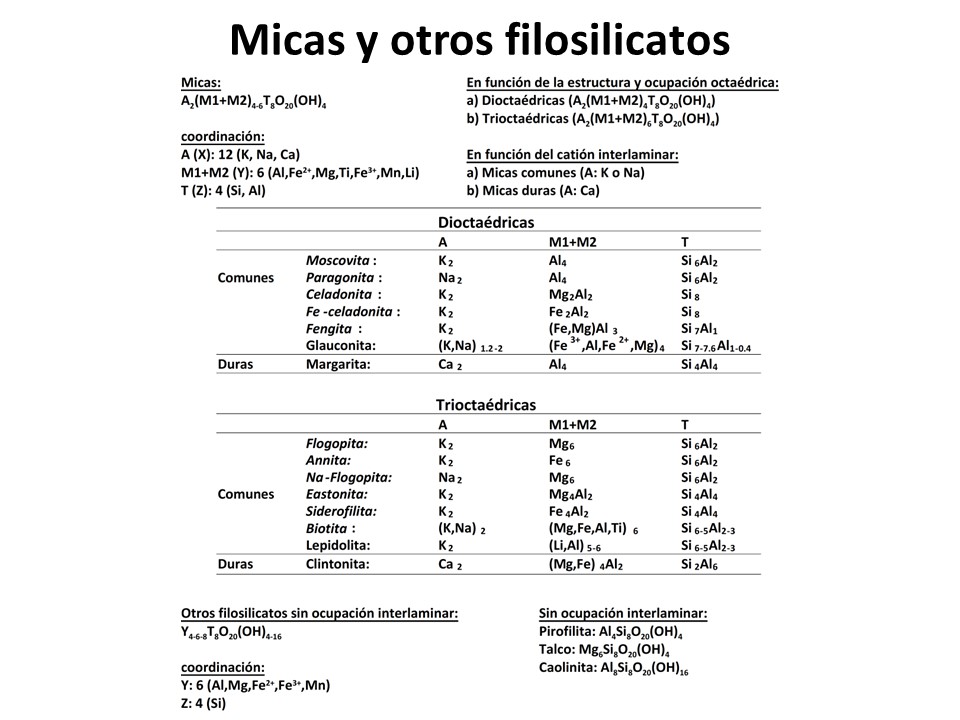
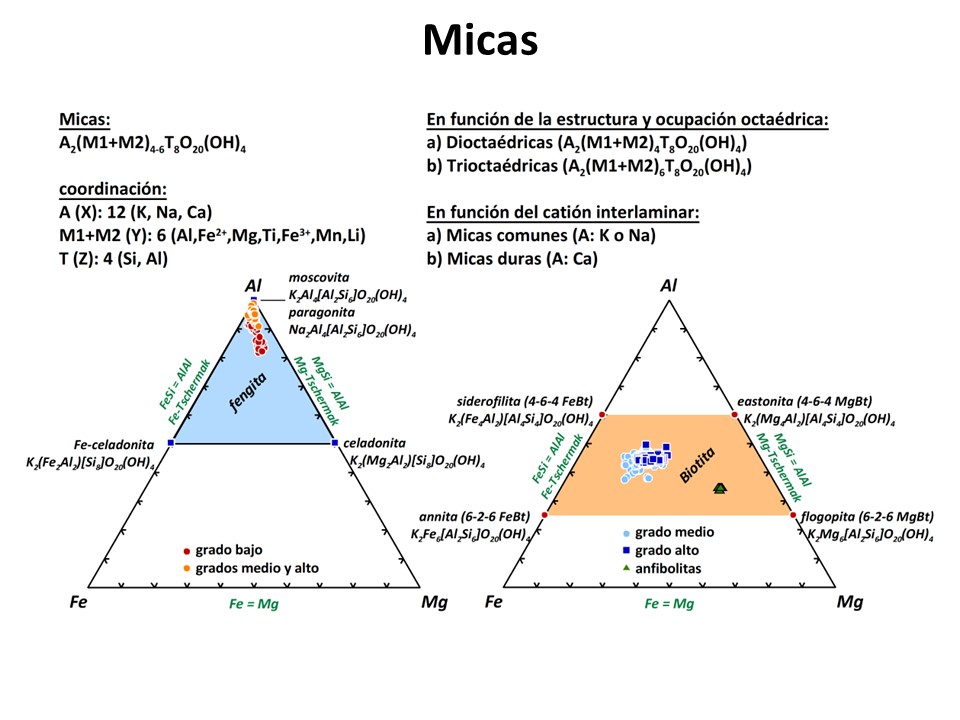
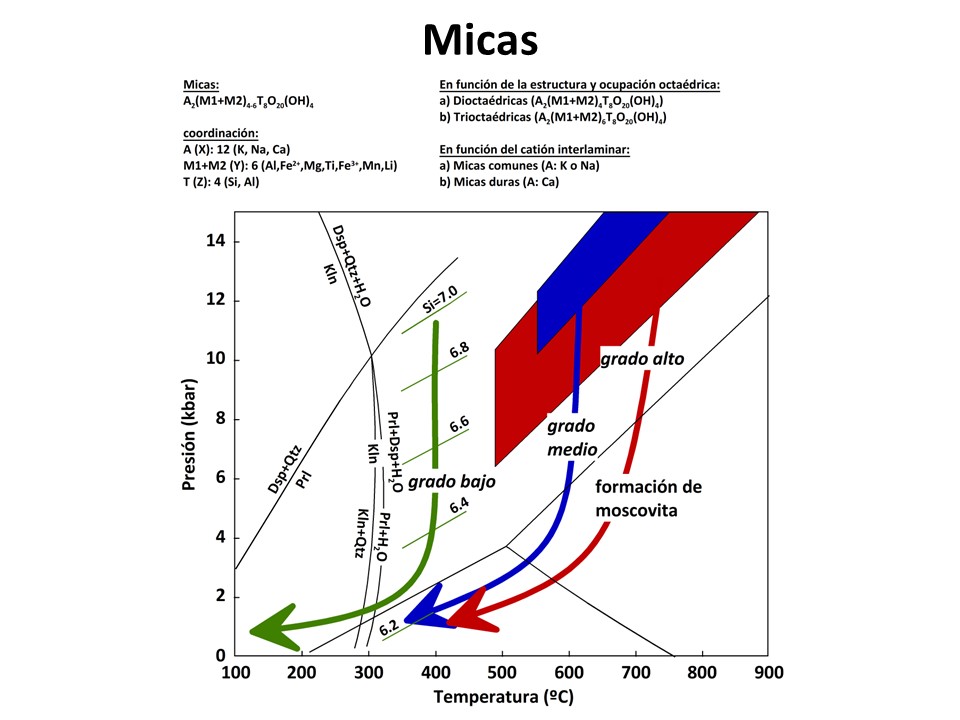
Micas y otros filosilicatos
Nomenclature
of the micas, 1998. M. Rieder et al. pdf (412 KB)
Handbook of Mineralogy
Muscovite:
https://rruff.geo.arizona.edu/doclib/hom/muscovite.pdf
Paragonite:
https://rruff.geo.arizona.edu/doclib/hom/paragonite.pdf
Celadonite:
https://rruff.geo.arizona.edu/doclib/hom/celadonite.pdf
Glauconite:
https://rruff.geo.arizona.edu/doclib/hom/glauconite.pdf
Margarite:
https://rruff.geo.arizona.edu/doclib/hom/margarite.pdf
Phlogopite:
https://rruff.geo.arizona.edu/doclib/hom/phlogopite.pdf
Annite:
https://rruff.geo.arizona.edu/doclib/hom/annite.pdf
Biotite:
https://rruff.geo.arizona.edu/doclib/hom/biotite.pdf
Lepidolite:
https://rruff.geo.arizona.edu/doclib/hom/lepidolite.pdf
Clintonite:
https://rruff.geo.arizona.edu/doclib/hom/clintonite.pdf
Wonesite:
https://rruff.geo.arizona.edu/doclib/hom/wonesite.pdf
Preiswerkite:
https://rruff.geo.arizona.edu/doclib/hom/preiswerkite.pdf


Ir a la cabecera de la página
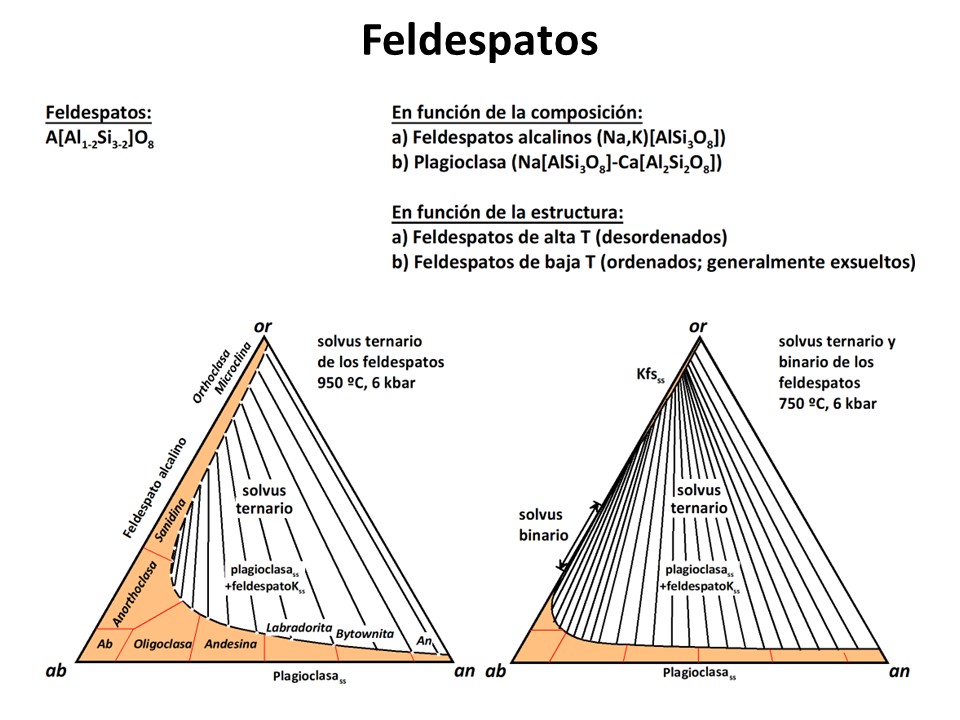
Feldespatos

Ir a la cabecera de la página
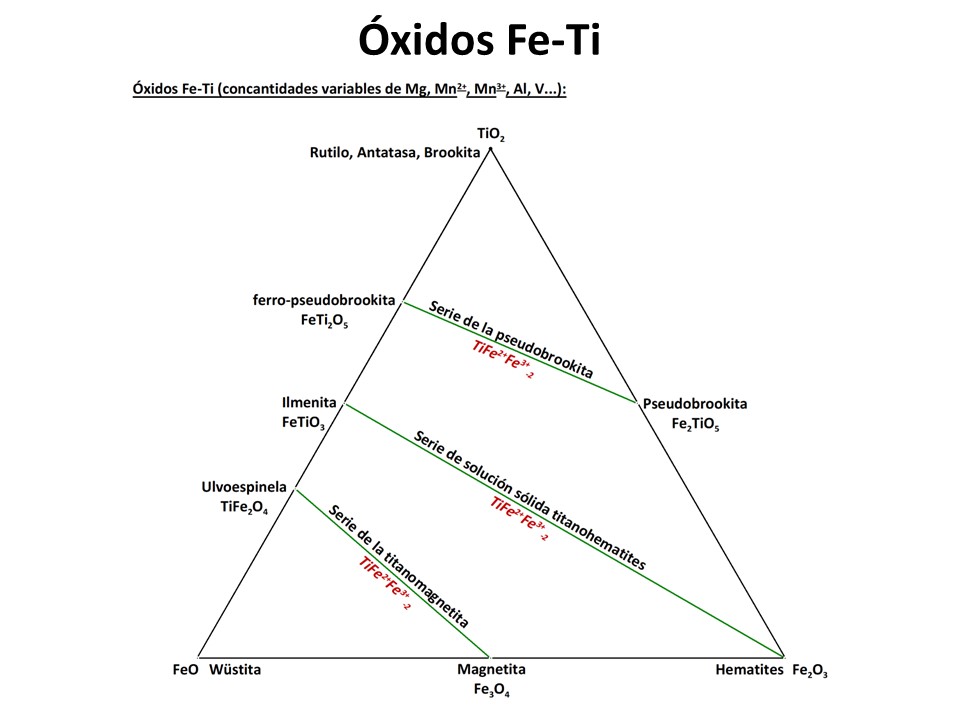
Espinelas y óxidos
Fe-Ti
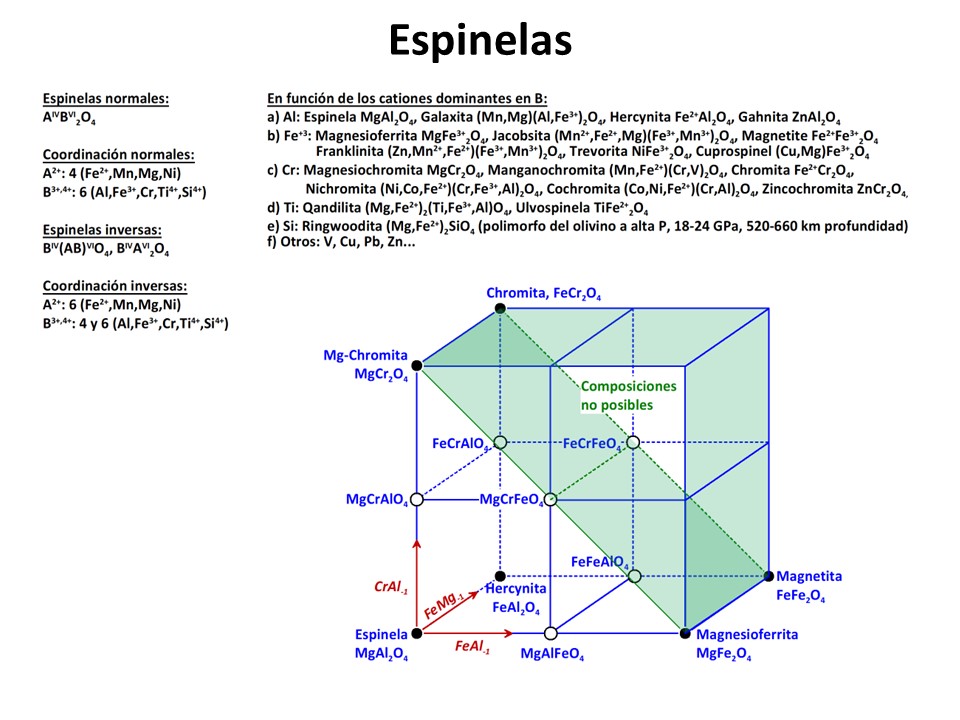
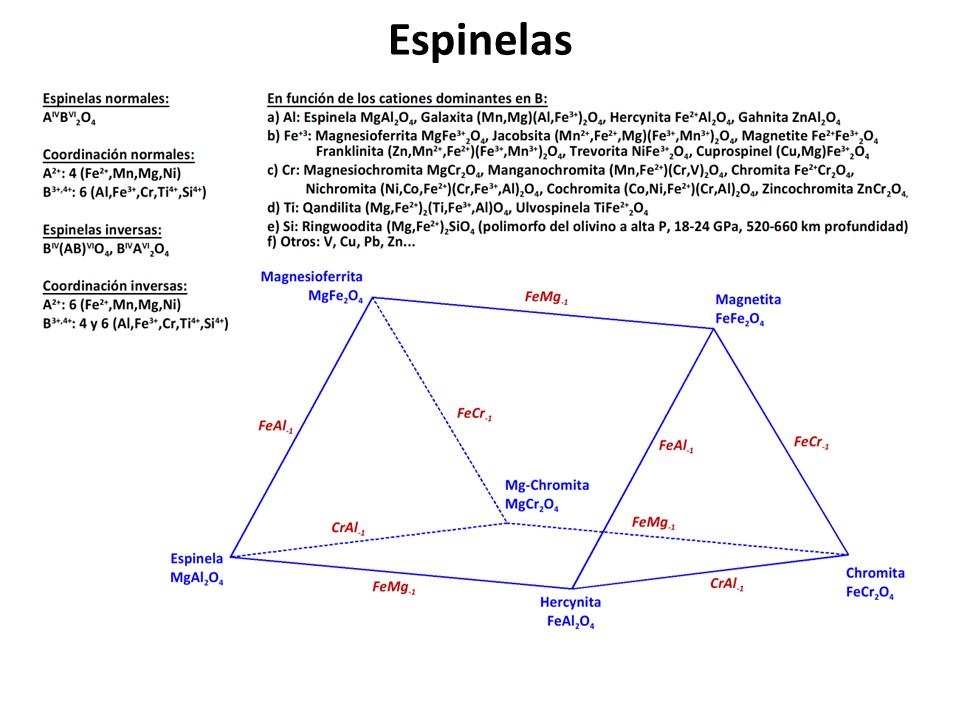
Vea M. Luján Ganuza et al., 2014 The Spinel Explorer—Interactive Visual Analysis of Spinel Group Minerals. IEEE Transactions on Visualization and Computer Graphics
20, 1913-1922. https://ieeexplore.ieee.org/document/6875977.
Ir a la cabecera de la página
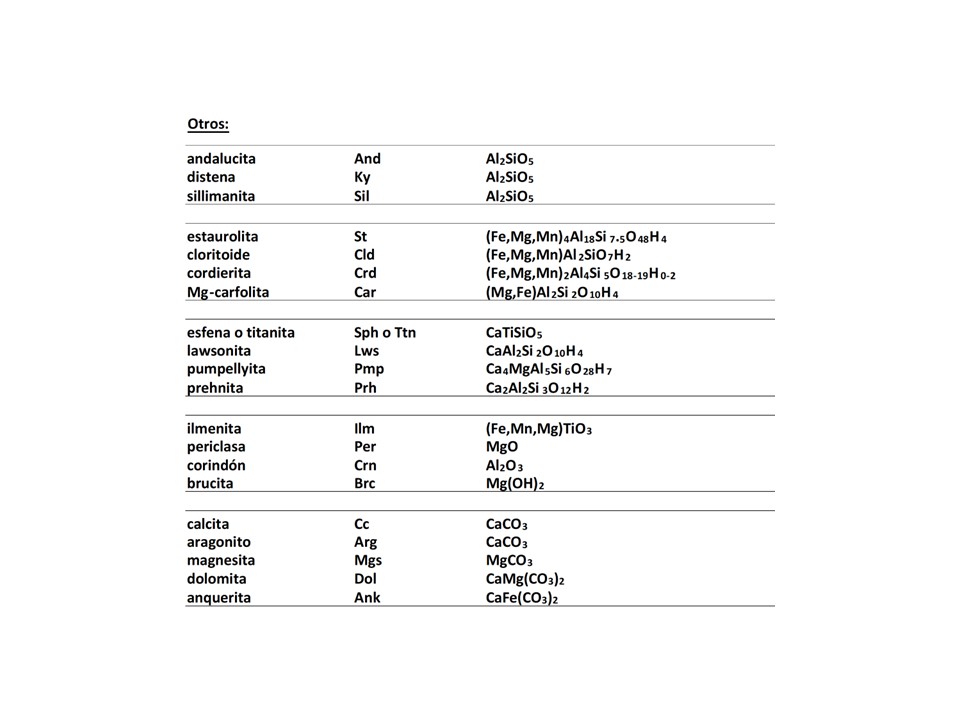
Otros
|