

Departamento de Microbiología e Instituto de Biotecnología
UNIVERSIDAD DE GRANADA
2. Fecundación y desarrollo embrionario
4.2 Paraclonación: por transferencia de núcleos de células embrionarias o fetales
4.3 Clonación (en sentido estricto): por transferencia de núcleos de células de individuos nacidos
5. Fines (teóricamente posibles) de los distintos tipos de clonación
6. Clonación no reproductiva y células madre
![]()
NOTA: Las imágenes de embriones de este documento han sido amablemente suministradas por la Dra. Ana Veiga, y son propiedad del Instituto Dexeus de Barcelona. Prohibida su reproducción sin consentimiento escrito.
![]()
El 27 de febrero de 1997 la revista científica Nature publicaba el informe sobre la primera clonación de un mamífero a partir del núcleo de una célula adulta de otro individuo. La “presentación en sociedad” de la oveja Dolly es uno de esos momentos en los que la ciencia espolea una plétora de reacciones emocionales de todo tipo, despertando sueños (o pesadillas) y reavivando mitos y viejos fantasmas.
Hay que diferenciar el uso de la palabra clonación en distintos contextos de la biología:
|
Si nos referimos al ámbito de la Ingeniería Genética, clonar es aislar y multiplicar en tubo de ensayo un determinado gen o, en general, un trozo de ADN. Sin embargo, Dolly no es producto de Ingeniería Genética. | |
|
En el contexto a que nos referimos, clonar significa obtener uno o varios individuos a partir de una célula somática o de un núcleo de otro individuo, de modo que los individuos clonados son idénticos o casi idénticos al original. |
En los animales superiores, la única forma de reproducción es la sexual, por la que dos células germinales o gametos (óvulo y espermatozoide) se unen, formando un zigoto (o huevo), que se desarrollará hasta dar el individuo adulto. La reproducción sexual fue un invento evolutivo (del que quedaron excluidas las bacterias y muchos organismos unicelulares), que garantiza que en cada generación de una especie van a aparecer nuevas combinaciones de genes en la descendencia, que posteriormente será sometida a la dura prueba de la selección y otros mecanismos evolutivos. Las células de un animal proceden en última instancia de la división repetida y diferenciación del zigoto.
Las células somáticas, que constituyen los tejidos del animal adulto, han recorrido un largo camino "sin retorno", de modo que, a diferencia de las células de las primeras fases del embrión, han perdido la capacidad de generar nuevos individuos y cada tipo se ha especializado en una función distinta (a pesar de que, salvo excepciones, contienen el mismo material genético).
El primer experimento de clonación en vertebrados fue el de Briggs y King (1952), en ranas. En los años 70, Gurdon logró colecciones de sapos de espuelas (Xenopus laevis) idénticos a base de insertar núcleos de células de fases larvarias tempranas en ovocitos (óvulos) a los que se había despojado de sus correspondientes núcleos. Pero el experimento fracasa si se usan como donadoras células de ranas adultas.
Desde hace unos años se vienen obteniendo mamíferos clónicos, pero sólo a partir de células embrionarias muy tempranas, debido a que aún no han entrado en diferenciación (y por lo tanto poseen la propiedad de pluripotencia). No es extraño pues el revuelo científico cuando el equipo de Ian Wilmut, del Instituto Roslin de Edimburgo comunicó que habían logrado una oveja por clonación a partir de una célula diferenciada de un adulto.[2] Esencialmente el método (que aún presenta una alta tasa de fracasos) consiste en obtener un óvulo de oveja, eliminarle su núcleo, sustituirlo por un núcleo de célula de oveja adulta (en este caso, de las mamas), e implantarlo en una tercera oveja que sirve como “madre de alquiler” para llevar el embarazo. Así pues, Dolly carece de padre y es el producto de tres "madres": la donadora del óvulo contribuye con el citoplasma (que contiene, además mitocondrias que llevan un poco de material genético), la donadora del núcleo (que es la que aporta la inmensa mayoría del ADN), y la que parió, que genéticamente no aporta nada.[3]
Científicamente se trata de un logro muy interesante, ya que demuestra que, al menos bajo determinadas circunstancias es posible "reprogramar" el material genético nuclear de una célula diferenciada (algo así como volver a poner a cero su reloj, de modo que se comporta como el de un zigoto). De este modo, este núcleo comienza a "dialogar" adecuadamente con el citoplasma del óvulo y desencadena todo el complejo proceso del desarrollo intrauterino.
Desarrollo de las células germinales femeninas: es un proceso muy prolongado, que arranca de la fase fetal, y que concluye en la adulta.
| Las señales intrafoliculares iniciales para la maduración del ovocito provocan el paso desde G2 hasta M de la meioisis. | |
| Reaparece el ARNm enmascarado, y se traduce. Movimientos de orgánulos citoplásmicos. |
Zigoto (célula huevo): finaliza la meiosis del óvulo, con eliminación del segundo cuerpo polar. Los procesos que ocurren durante las primeras horas son:
| Se duplica el ADN de los genomas haploides de cada gameto | |
| Singamia: aproximación de los pronúcleos de cada gameto, pero sin fusión nuclear. | |
| Primera división mitótica: los cromosomas quedan engarzados en el huso mitótico, y las cromátidas hermanas se separan. |
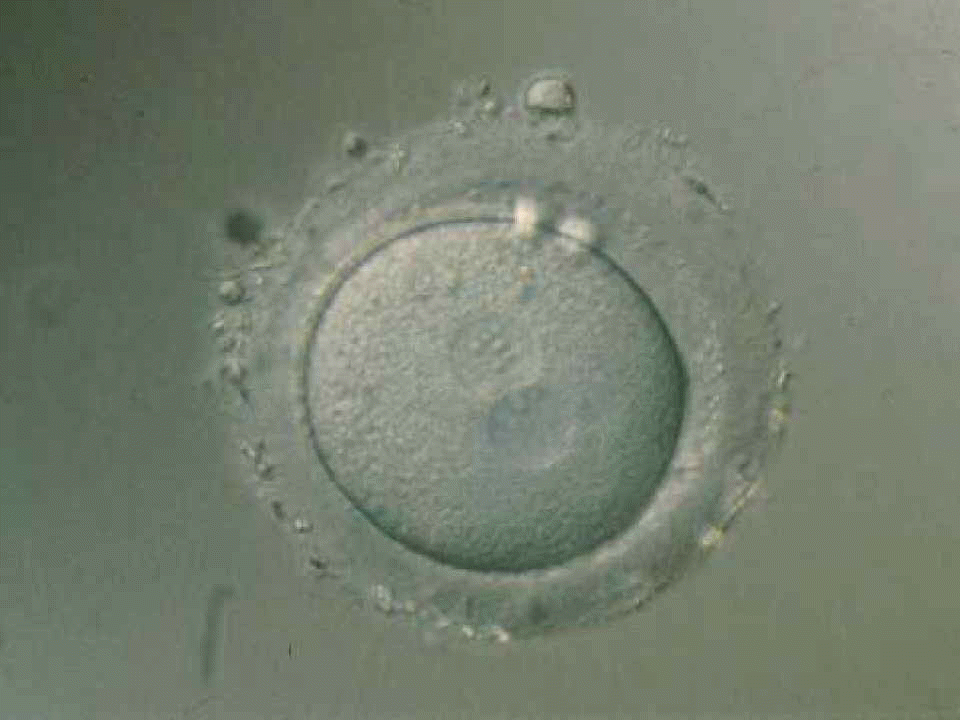 |
Cigoto humano con los dos
pronúcleos, antes de su singamia (obsérvese la cubierta o zona
pelúcida)
© Instituto Dexeus, Barcelona |
El embrión se va dividiendo, originando duplicación de las células (blastómeros):
| 2 células (a las 26 horas) | |
| 4 células (38 h) | |
| 8 células (46 h) | |
| 16 células (68 h) |
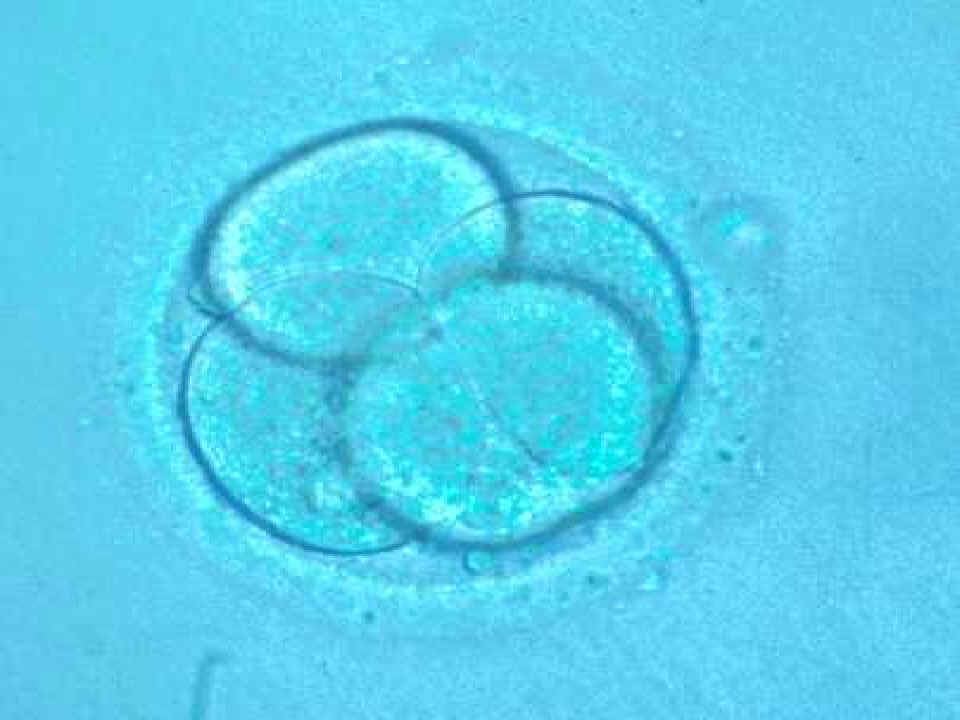 |
Embrión humano en fase de 4 células
© Instituto Dexeus, Barcelona
|
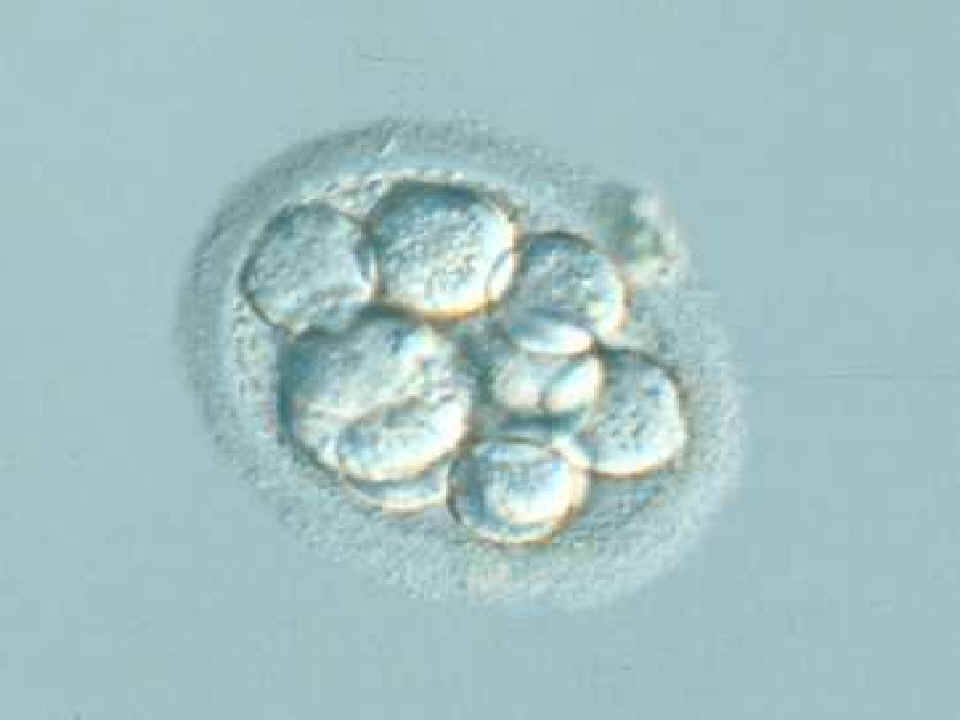 |
Embrión humano de 12 células
© Instituto Dexeus, Barcelona |
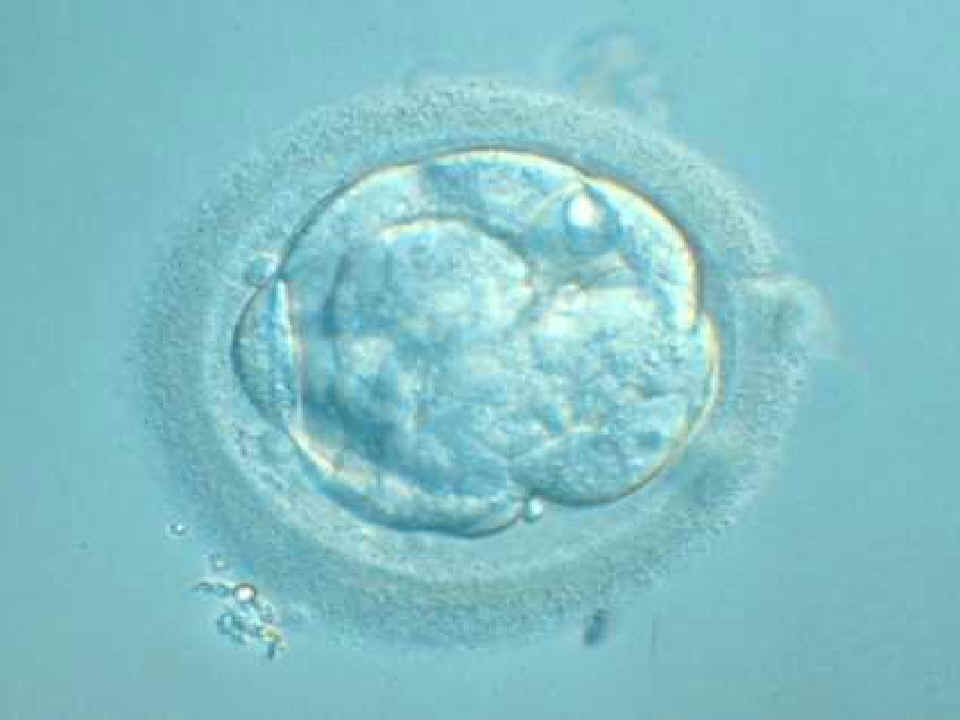 |
Embrión humano en fase de mórula (masa
compacta de células de tamaño similar)
© Instituto Dexeus, Barcelona |
Mórula: fase de 12-16 blastómeros (3º-4º día). Aspecto de pelota compacta, antes de la entrada en el útero.
Blastocisto: hueco interior, con la masa celular interna (estructuras embrionarias) y capas externas (trofectodermo)
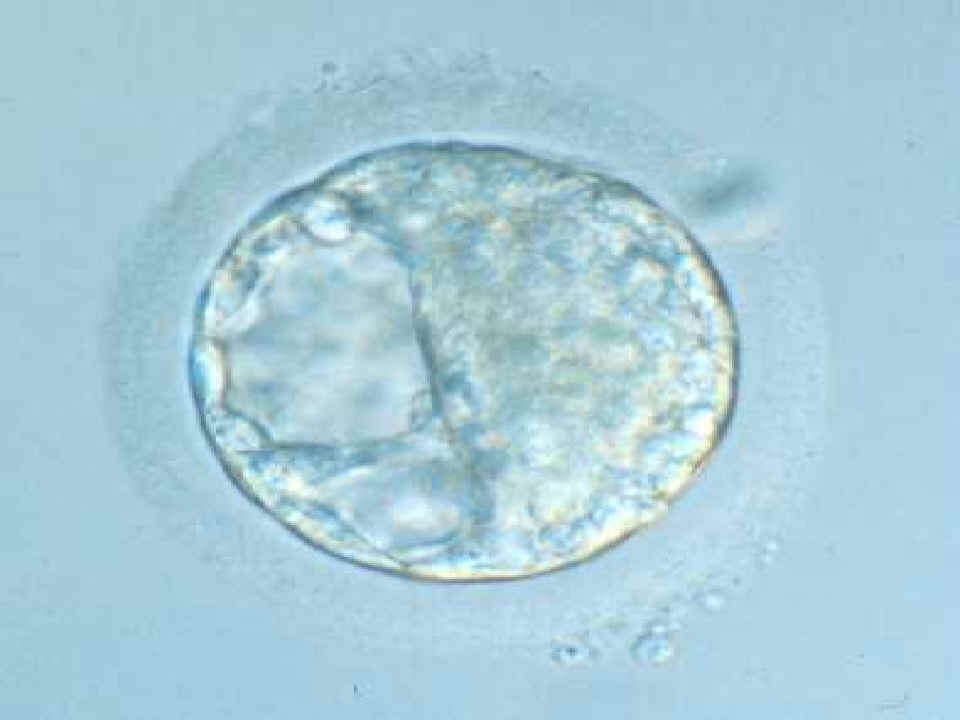 |
El embrión se convierte en blastocisto, por
cavitación (obsérvese la cavidad, aún pequeña)
© Instituto Dexeus, Barcelona |
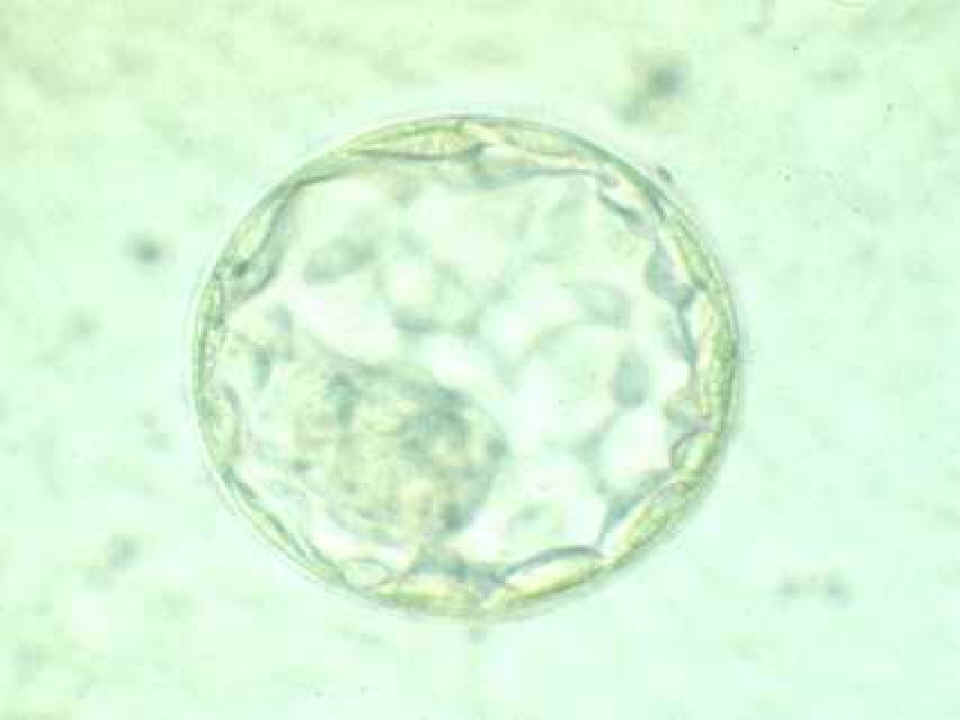 |
Blastocisto en expansión
© Instituto Dexeus, Barcelona |
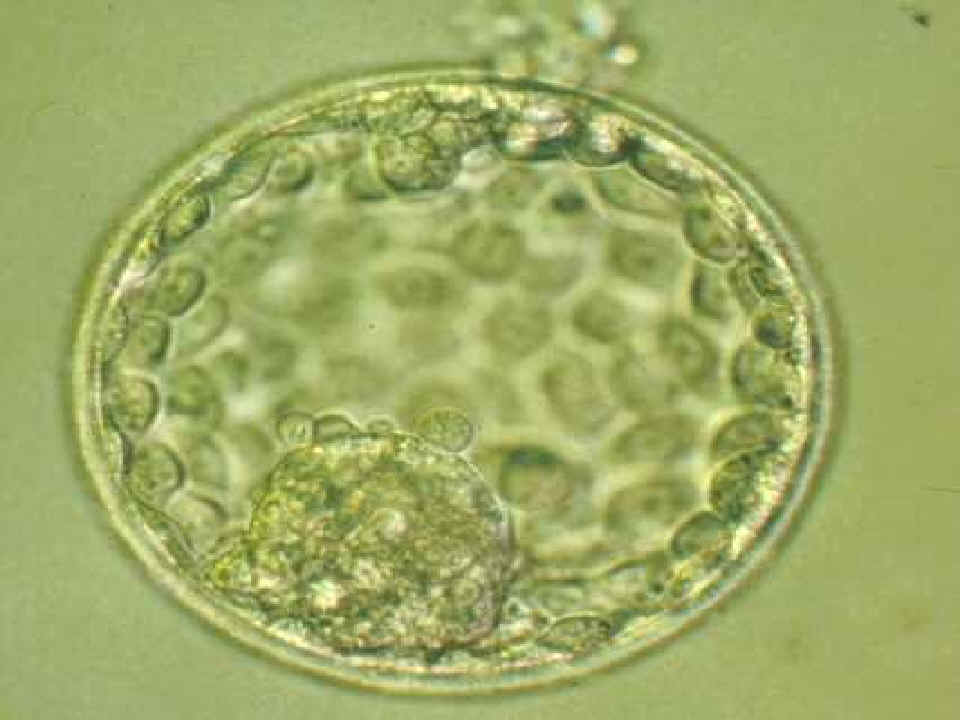 |
Blastocisto expandido. Obsérvese la gran
cavidad y la masa celular interna
© Instituto Dexeus, Barcelona |
Implantación: comienza al final de la 1ª semana, y termina al final de la 2ª.
Fase embrionaria dura hasta la 8ª-9ª semana, cuando quedan establecidos los rudimentos de todos los órganos[5].
|
Gástrula (15º-18º día): tres capas germinales (ecto, meso y endodermo). La actuación de ciertos productos génicos (de tipo Noggin) provoca la inducción neural, que genera la placa neural (primordio de la cuerda espinal y del cerebro). | |
|
Durante el 2º mes de embarazo, tras adquirir el “diseño general” el desarrollo conduce a la diferenciación general del sistema. Organogénesis hasta el 3º mes. | |
|
El resto del embarazo: sigue la diferenciación-maduración. Desarrollo fetal (3º mes hasta el nacimiento). |
Aspectos relevantes para el trasplante de núcleos:
El trasplante de núcleos somáticos a óvulos enucleados tiene la intención de lograr lo que hacen de modo natural los dos pronúcleos del ovocito recién fertilizado.
Cuando entra el espermatozoide, éste se encuentra en fase Go, mientras que el ovocito está en la segunda metafase meiótica (MII). Luego se descondensa el núcleo del espermatozoide y se sincronizan ambos ciclos celulares, ingresando al mismo tiempo en la fase S (síntesis de ADN).
|
Fase de diferenciación: Durante las 48 horas previas a la fecundación las gonadotrofinas actúan sobre el folículo, cuyas células somáticas responden produciendo señales que reprograman al ovocito. Se usa el ARN almacenado en la fase previa | |
|
En la activación del ovocito por el espermatozoide intervienen aumentos cíclicos de Ca++ intracelular. | |
|
Ello provoca el descenso de actividad de la MPF[6]-quinasa (por degradación de la ciclina B y fosforilación de cdc2). | |
|
Ello inhibe las moléculas bloqueadoras de la metafase II, lo que hace que el óvulo termine la mitosis. | |
|
Se desenmascaran más ARNm, que se traducen. |
Al introducir un núcleo somático, tenemos que lograr sincronizarlo con la fase del ovocito y “remedar” los cambios fisiológicos arriba citados. Algunos de los protocolos artificiales estimulan la entrada de Ca al ovocito.
|
La electroestimulación provoca un aumento de Ca++ único, pero no las oleadas de Ca++. | |
|
Se mejora con pulsos de corriente o por ionomicina. | |
|
Pero aún necesitamos mejorar para simular las condiciones naturales. |
Requisitos de ciclo celular:
|
Sincronización núcleo-citoplasma. | |
|
Periodo de reprogramación nuclear, para su adaptación al entorno citoplásmico. | |
|
Si se usan núcleos de células diferenciadas, deben “desdiferenciarse” para lograr la totipotencia. Ello solo puede conseguirse con el citoplasma meiótico en fase M. El grupo de Wilmut (1996) concluyó que el éxito aumenta con núcleos somáticos en fase G0 y citoplasmas en fase MII. |
En el reciente trabajo sobre la clonación de ratones[7], las condiciones mejores fueron:
|
La activación se realiza dejando un cierto tiempo (6 horas) tras la inyección del núcleo donante en G0. | |
|
La activación se induce con estroncio y citocatalasina B (con supresión de citoquinesis). Aunque esto parece paradójico en relación con otros informes, la exposición prolongada de los núcleos entrantes a un ambiente rico en MPF causa una duradera condensación de cromosomas (en ausencia de síntesis de ADN), y puede facilitar los cambios nucleares que son esenciales para el desarrollo e implantación del blastocisto. | |
|
Puede que influya también el uso de una unidad de micropipeta de piezo-impacto, que permite que las manipulaciones del oocito y del embrión sean rápidas y eficaces, reduciendo así el trauma de otros métodos (electrofusión, Virus Sendai o PEG). |
Pero incluso el “dogma” de la necesidad de usar células quiescentes como donantes parece que se tambalea: la reciente clonación de ratones usando células madre en fase G1 o en post-fase S (fases G2 y M) así lo indica.[8] Recientemente, el grupo de PPL-Roslin, ha logrado cinco cerdos clónicos mediante un nuevo procedimiento de doble transferencia nuclear, a partir de células no quiescentes (I.A. Polejaeva et al. [2000]: “Cloned pigs produced by nuclear transfer from adult somatic cells”, Nature 407: 86-90).
Por ahora, parece que no todas las células somáticas son susceptibles de poder usarse como donantes de núcleos para la clonación. Se desconoce si se trata de un problema biológico o meramente técnico. Si es biológico, habrá que investigar qué es lo que hace que algunas células sean reprogramables y otras no, y cuál es la naturaleza de la reprogramación (obviamente debe haber activación y represión de genes). ¿Tiene algo que ver en la tasa de fracasos algo relacionado con la impronta genética?
| Gemelos dizigóticos (no idénticos): se originan por la fecundación de dos o más óvulos por distintos espermatozoides. Tasa de 0.6-1-1%nacimientos. Gran heredabilidad e incidencia de factores ambientales (nutrición, edad, etc.) | |
| Gemelos monozigóticos (idénticos): por fisión de un embrión temprano. 0.3-0.4% de nacimimientos. |
Tipos de clonación según el método
Partición de un embrión, o separación de blastómeros en embriones preimplantatorios (de 2-32 células). Cada mitad o trozo desgajado del embrión se introduce en una zona pelúcida de otro óvulo, o en una cubierta artificial (ZPA), y se implanta.
|
Embriones se mojan en 1% de alginato y se transfieren a medio con Cl2Ca, que induce la polimerización. | |
|
En ratones, tiene éxito con blastómeros separados en fase de 2 células. Pero los blastómeros de embriones de 4-8 células pueden suministrar células para la masa celular interna y para el trofectodermo si se incorporan junto con blastómeros de otros embriones. |
Se viene aplicando desde hace años en ganadería. Estudios de Willadsen (1979 y 1981) sobre ovejas: algunos blastómeros de embriones de 4-8 células pueden originar individuos completos.
Recientemente se ha hecho en monos (macacos Rhesus)[11]
En humanos hubo un experimento polémico (Hall y Stillman, 1993) con un zigoto poliploide inviable (no se pretendía implantarlo). Más estudios del equipo de Paul Gindoff de la Universidad G. Washington con embriones anómalos: los embriones más tempranos son mejores para la separación de blastómeros. La ZP natural se disgrega con pronasa y se colocan los embriones en Ca para separar los blastómeros. Inclusión de blastómeros en ZPA de alginato. La capacidad de división de los blastómeros de fases de 2 células era de 3 divisiones, y disminuía con blastómeros más tardíos.
El resultado son individuos prácticamente idénticos entre sí (salvo mutaciones somáticas), pero diferentes a sus padres. Serían equivalentes a gemelos monozigóticos.
No se debe considerar como clonación en sentido estricto.
Los núcleos pueden proceder de:
| Blastómeros de embrión preimplantatorio: las células de la masa celular interna como las del trofectodermo son totipotentes. |
| Células embrionarias o fetales de un cultivo primario o de un cultivo celular. |
Estos núcleos se transfieren a un óvulo enucleado o a un zigoto al que se le hayan eliminado los pronúcleos. Este óvulo receptor aporta mitocondrias, y en el caso del zigoto, algo del espermatozoide.
El resultado: individuos casi idénticos entre sí, pero diferentes de los progenitores del embrión que aportó el núcleo transferido. Se pierde una generación, ya que el embrión donante del núcleo se destruye. Los individuos nacidos así se parecerían (desde el punto de vista del genoma nuclear) al individuo que hubiera surgido del embrión destruido.
A mitad de los 80 se venían produciendo paraclonaciones en diversos animales de granja: ovejas y vacas.[12] Willadsen logró terneros por transferencia de núcleos de embriones en fase de hasta 128 células. En 1996 el equipo de Wilmut y Campbell logró dos ovejas (Megan y Morag) por transferencia de núcleos de embriones. PPL siguió con experimentos de paraclonación con células embrionarias y fibroblastos fetales.[13]
Se ha descrito igualmente la producción de monos Rhesus por transferencia de núcleos de blastómeros[14].En un caso se dividieron 107 embriones en 368 unidades, lográndose 4 embarazos, de uno de los cuales nació Tetra. [15] Alguno de los intentos condujo a embarazos “ciegos”, consistentes en un saco placentario desprovisto de tejido fetal. En una postdata los autores anuncian que acaban de lograr 4 embarazos, cada uno con un feto viable, a partir de los últimos 7 embriones originados por separación de blastómeros. Dos de los fetos son gemelos idénticos por fisión de un embrión original. Nacieron vivos y se llaman Neti y Ditto.
Se ha empleado en animales transgénicos clónicos. Polly (julio 1997), de PPL, es una oveja paraclónica (núcleo donante: fibroblastos fetales) transgénica productora de factor IX de coagulación humano[16]. Intentos de cerdos modificados para xenotrasplantes.
Un avance reciente significativo es la clonación de decenas de ratones empleando núcleos de células madre no quiescentes, realizado por un equipo de la Universidad de Hawai y la Universidad Rockefeller[17]. Una de las mayores incidencias de este trabajo es que demuestra que se puede clonar con núcleos de células en cultivo bien caracterizadas, y no solamente con células frescas o cultivos primarios. Como las células madre de ratón se manejan bien desde el punto de vista genético, esto abre la vía a la fácil creación de ratones clónicos y transgénicos.
El núcleo procede de individuo nacido. Se transfiere a óvulo o zigoto enucleados, y el embrión se implanta en útero. El resultado: individuos casi idénticos entre sí y casi idénticos a su progenitor (donante del núcleo).
Se ha logrado en varias especies[18]:
| Oveja (Dolly). Núcleo donante de célula sin identificar de ubre de oveja de 6 años de la raza Finn Dorset. Embrión implantado en hembra Scottish Blackface. Baja tasa de éxitos: 430 óvulos, de los que se obtuvieron 277 óvulos reconstituidos, que se cultivaron por separado durante 6 días. 29 blastocistos “normales” se transfirieron a hembras receptoras. El único éxito fue Dolly. Algunos fueron fetos o neonatos muertos, o con alteraciones del desarrollo. |
| Ratones, con núcleos del cúmulo oóforo[19]. (El primer ratón clónico nació el 3 de octubre de 1997, y fue llamado Cumulina; ya ha tenido progenie aparentemente normal, que a su vez se ha reproducido). El haber obtenido clones en esta especie de laboratorio, con ciclo de vida corto y de la que se tienen amplios conocimientos de su genética, abre perspectivas insospechadas para los estudios básicos sobre la clonación: mecanismos de la reprogramación celular, impronta (imprinting) genómica, activación del genoma del embrión, diferenciación celular, etc. Poco después, este mismo equipo japonés informó de la clonación de ratones a partir de células del rabo de ratones adultos.[20] | |
| Ganado bovino: núcleos de células epiteliales del oviducto, del cúmulo oóforo, [21] epiteliales, musculares. | |
| Ganado caprino. | |
| Recientemente se ha logrado en ganado porcino: el grupo de Roslin-PPL lo ha conseguido con un nuevo método de doble transferencia nuclear, con el nacimiento de cinco lechones, con dos subgrupos de tres y dos que eran clones entre sí y con respecto al correspondiente donante. Sus nombres: Millie, Christa, Alexis, Carrel y Dotcom. (I.A. Polejaeva et al. [2000]: “Cloned pigs produced by nuclear transfer from adult somatic cells”, Nature 407: 86-90). |
El grupo de Wakayama, en el artículo reciente que informa sobre clonación de ratones a partir de núcleos de células madre, propone un posible esquema que permitiría la clonación ilimitada a partir de casi cualquier célula del organismo (al menos en esta especie)[22]:
En animales:
| Investigación básica | |
| Mejora de FIV | |
| Mejora de fertilidad de las especies empleadas. |
En humanos:
| En FIV, para mejorar resultados en mujeres con pobre estimulación ovárica | |
| Gemelos idénticos separados en el tiempo |
En animales:
| Individuos idénticos para investigación | |
| Producción ganadera | |
| Junto con clonación, para biotecnología: tejidos “humanizados”, granjas farmacéuticas | |
| Fuentes de tejidos, para xenotrasplantes |
En humanos:
| ¿investigación básica y aplicada? | |
| ¿Terapia? Para enfermedades mitocondriales que producen ceguera o epilepsia: transferencia del núcleo del embrión hasta un óvulo-zigoto recepetor. |
En animales:
mejora
de conocimientos en biomedicina
| |||||||||
Ganadería:
| |||||||||
Intentos
de salvar in extremis a especies de la extinción (p. ej, el panda
gigante, un bóvido salvaje asiático llamado gaur, etc.). Incluso alguien está intentando "resucitar" especies
extinguidas de las que hay material biológico conservado (alguna especie de
marsupial australiano como el tigre de Tasmania, el bucardo -una subespecie
de cabra montés recientemente desaparecida del Pirineo español).
|
En humanos, la clonación verdadera podría tener dos usos diferentes:
Clonación
reproductiva: tal como se describe arriba, para crear un individuo clónico.
Posibles situaciones:
| |||||||||||||||||||||||||||
Clonación
no reproductiva: se realiza la manipulación celular como en la anterior,
pero el embrión no se implanta en útero, sino que puede servir a distintos
objetivos, principalmente de investigación:
|
![]()
| Ética de clonación reproductiva | |
| Aspectos de seguridad no resueltos en la tecnología de clonación | |
| Aspectos éticos y sociales de la clonación no reproductiva, incluyendo el actual debate sobre clonación "terapéutica" y uso experimental de embriones humanos |
![]()
[1] Para un resumen histórico y conceptual, J.R. Lacadena (1998): “La clonación humana”, en Actas del 2º Congreso de bioética de América Latina y del Caribe, Santafé de Bogotá, pp. 138-165, y el cap. 1 de Comité de expertos sobre bioética y clonación (1999): Informe sobre la clonación: en las fronteras de la vida, Instituto de Bioética de la Fundación Ciencias de la Salud, Ediciones Doce Calles, Madrid. Véase igualmente National Bioethics Advisory Comisión (2000): “Ciencia y aplicación de la clonación” (parte del informe original de 1997 de la NBAC), en Clones y clones. Hechos y fantasías sobre la clonación humana (M.C. Nussbaun y C.R. Sunstein, eds.), Cátedra, Madrid, pp. 39-48.
[2] I. Wilmut, A.E. Schnieke, J. McWhir, A.J. Kind, K.H.S. Campbell (1997): “Viable offspring derived from fetal and adult mammalian cells”, Nature 385: 810-813.
[3] Un artículo de divulgación sobre algunas modalidades de clonación y sus posibilidades terapéuticas: I. Wilmut (1999): “Clonación con fines médicos”, Investigación y Ciencia 269: 24-29.
[4] Véase el cap. 2 de Comité de expertos sobre bioética y clonación (1999): Informe sobre la clonación: en las fronteras de la vida, Instituto de Bioética de la Fundación Ciencias de la Salud, Ediciones Doce Calles, Madrid. Igualmente útil es R. Moor, C. Lee y J. Fulka (1998): “El contexto de la clonación: células germinales, fecundación y desarrollo embrionario”, en En las fronteras de la vida: ciencia y ética de la clonación, Fundación Ciencias de la Salud, Ediciones Doce Calles, Madrid, pp. 22-51.
[5] J.R. Lacadena (1995): “Consideraciones genético-biológicas sobre el desarrollo embrionario humano”, en Genética Humana: Fundamentos para el estudio de los efectos sociales de las investigaciones sobre el genoma humano (ed.: C.M. Romeo Casabona), Univerdidad de Deusto y Fundación BBV, Bilbao, pp. 77-103.
[6] MPF es el factor promotor de la mitosis.
[7] T. Wakayama, A.C.F. Perry, T. Zuccotti, K.R. Johnson, R. Yanagimachi (1998): “Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei”, Nature 394: 369-374.
[8] T. Wakayama, I. Rodríguez, A.C.F. Perry, R. Yanagimachi, P. Mombaerts (1999): “Mice cloned from embryonic stem cells”, Proceedings of the National Academy of Sciences 96: 14984-14989.
[9] Véase el cap. 3 de Comité de expertos sobre bioética y clonación (1999): Informe sobre la clonación: en las fronteras de la vida, Instituto de Bioética de la Fundación Ciencias de la Salud, Ediciones Doce Calles, Madrid.
[10] P. R. Gindoff (1998): “Clonación por separación embrionaria”, En las fronteras de la vida: ciencia y ética de la clonación, Fundación Ciencias de la Salud, Ediciones Doce Calles, Madrid, pp. 52-61.
[11] A.W. Chan, T. Dominko, C.M. Luetjens, E. Neuber, C. Martinovich, L. Hewitson, C.R. Simerly, G.P. Schatten (2000): “Clonal propagation of primate offspring by embryo splitting”, Science 287: 317-319.
[12] M.Sims, N.L. First (1994): “Production of calves by transfer of nuclei from cultured inner mass cells”, Proceedings of the National Academy of Sciences 91: 6143-6147; S.M. Willadsen (1986): “Nuclear transplantation in the bovine embryo: assessment of donor nuclei and recipient oocyte”, Biology of Reproduction 37: 859-866.
[13] K.H.S. Campbell, J. McWhir, W.A. Ritchie, I. Wilmut (1996): “Sheep cloned by nuclear transfer from a cultured cell”, Nature 380: 64-66.
[14] L. Meng, J.J. Ely, R.L. Stouffer, D.P. Wolf (1997): “Rhesus monkeys produced by nuclear transfer”, Biology of Reproduction 57: 454-459.
[15] D. P. Wolf, L. Meng, N. Ouhibi, M. Zelinski-Wooten (1999): Biology of Reproduction 60: 199.
[16] A.E. Schieke, A.J. Kind, W.A. Richtie, K. Mycock, A.R. Scott, M Ritchie, I. Wilmut, A. Colman, K.H.S. Campbell (1997): “Human factor IX transgenic sheep produced by transfer of nuclei from transfected fetal fibroblasts”, Science 278: 2130-2133.
[17] T. Wakayama, I. Rodríguez, A.C.F. Perry, R. Yanagimachi, P. Mombaerts (1999): “Mice cloned from embryonic stem cells”, Proceedings of the National Academy of Sciences 96: 14984-14989.
[18] Véase comentario de D. Solter (1998): “Dolly is a clone-and no longer alone”, Nature 394: 315-316.
[19] T. Wakayama, I. Rodríguez, A.C.F. Perry, R. Yanagimachi, P. Mombaerts (1999): “Mice cloned from embryonic stem cells”, Proceedings of the National Academy of Sciences 96: 14984-14989.
[20] T. Wakayama, R. Yanagimachi (1999): Nature Genetics 22: 127-128.
[21] K. Kato, T. Tani, Y. Sotomaru, K. Kurokawa, J.-Y. Kato, H. Doguchi, H. Yasue, Y. Tsunoda (1998): “Eight calves cloned from somatic cells of a single adult”, Science 282: 2095-2098. Otro caso es el comentado por D. Butler (1998): “French clone provides support to Dolly”, Nature 392: 113.
[22] T. Wakayama, I. Rodríguez, A.C.F. Perry, R. Yanagimachi, P. Mombaerts (1999): “Mice cloned from embryonic stem cells”, Proceedings of the National Academy of Sciences 96: 14984-14989.
[23] J.B. Cibelli et al (1998): “Cloned transgenic calves produced from nonquiescent fetal fibroblasts” Science 280: 1256-1258.
[24] P. G. Shields et al. (1999): “Analysis of telomere lengths in cloned sheep”, Nature 399: 316-317.
![]()
![]()
![]()